Bakterilerde Enzimler
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji1
01. Genel Bilgiler
02. Enzimlerde Aktif Bölgeler
03. Enzimlerin İsimlendirilmesi
04. Kofaktörler
05. Enzim Aktivitesine Etkileyen Faktörler
06. Enzim Aktivitesinin Ölçülmesi
07. Bakteri Enzimlerinin Karakterleri
08. Enzim Sentezinin Regulasyonu
01. Genel Bilgiler
Enzimler, canlı hücreler tarafından sentezlenen, organik ve katalitik kimyasal bileşiklerdir. Bunlar, hücre içindeki biyokimyasal reaksiyonları hızlandırırlar ve reaksiyona giren maddelerle (substrat) geçici kimyasal birleşmeler yaparlar. Bunların yardımı olmadan reaksiyonlar çok yavaş cereyan eder. Enzimlerin iştirak ettiği reaksiyonların hızı, enzimsiz olanlardan, 108-1010 defa daha fazladır. Mikroorganizmaların enzimleri hücre içinde sentezlenirler. Bunların bir kısmı, asimilasyon ve dissimilasyon olayları için, hücre içinde alıkonulurlar (endoenzimler, intrasellüler enzimler). Diğer bir kısmı ise, dış ortama salgılanarak, büyük moleküllü maddelerin (protein, polisakkarid, lipid, vs.) hidrolizasyonunda görev yaparlar (ekzoenzimler, ekstrasellüler enzimler). Reaksiyonların başında substratlarla geçici bileşikler oluşturan enzimler, reaksiyon bittikten sonra onlardan ayrılarak yeni reaksiyonları katalize etmek için eski formlarına dönerler. Kaybolmadıkları için çok az miktarı (bir kaç molekül) bile kısa bir süre içinde çok sayıdaki biyokimyasal reaksiyonları katalize edebilir. Örn; 2 ml konsantre trypsin, 37 °C' de ve pH 7.5' de, 2.5-3 kg. sığır etinin hidrolizasyonu için yeterlidir. Saf enzimlerde bu oran genellikle 10-5 ile 10-6 arasındadır.
Enzimlerin sentezinde ve yapısında oluşan çok az değişmeler bile, enzimin aktivitesine olumsuz yönde etkilediğinden, bunların katalize ettiği biyokimyasal reaksiyonların bozulmasına veya yön değiştirmesine neden olur. Bu değişiklikler sonu, gelişme ve üreme durabilir ve bakteriler ölebilirler. Her enzim substrat üzerinde, ancak bir kademeli reaksiyonu katalize edebilir. Bu nedenle, metabolizma olayları sırasında, bir seri enzim reaksiyonları devreye girer ve birbiri ardı sıra devam ederler. Enzimler spesifiktir ve substrata özeldirler. Örn, proteinlere etkileyenler karbonhidrat ve lipidlere tesir etmezler; L-amino asitleri hidrolize edenler, D-amino asitlere etkilemezler; L-arginin'e tesir eden (arginase), D-arginin için etkisizdir. Bu tarz etkileme, enzim molekülü ile subtrat molekülü arasındaki özel kimyasal ilişkiden ileri gelmektedir.
Hücrelerde enzim reaksiyonları genellikle geriye dönüşebilir (reversible) ve ortamda yeterince yeni ürünler birikince veya substrat tam hidrolize olunca, reaksiyon yavaşlar ve durur. Ancak, bakterilerde hücre içinde sentezlenen enzimlerin bir kısmı dışarı salgılandığından, böyle enzimlerin sentezlenmesi genellikle duraklamaz.
Enzimler protein yapısında ve kolloidal karakterde olduklarından, fiziksel (ısı, pH, UV-ışınları, osmotik basınç, vs.) ve kimyasal (asit, alkali, metabolitler, mineraller, vs.) faktörlerden etkilenirler. Etanol ve amonyum sulfatla presipite olan ve membranlardan diyalize olmayan enzimler, 10000 ile milyon arasında değişen yüksek bir molekül ağırlığına sahiptirler. En küçük enzimde 100 kadar amino asit bulunmaktadır (ribonuklease 125 amino asit ve MA 14000). Enzim spesifitesini oluşturan nedenlerin başında, bunların yapıları gelmektedir. Enzimlerin yapısı, polipeptid zincirindeki aminoasitlerin sayısı ve dizilişi (primer yapı), peptid zincirinin helikal durumu (sekonder yapı) ve peptidlerin kendi üzerine katlanma tarzları (tersiyer yapı) olmak üzere, başlıca 3 ayrı özellik gösterir. Enzimlerin yapısı ve enzim reaksiyonları genetik kontrol altındadır.
Enzimler birbirlerinden az-çok farklı 2 kısımdan oluşurlar. 1-Apoenzim: Protein karakterinde, kolloidal, ısıya dayanıksız, diyalize olmayan ve inaktif bir kısım (polipeptid zinciri veya zincirleri) 2- Koenzim (prostetik grup): Protein karakterinde olmayan, ısıya dayanıklı (termostabil), düşük moleküllü ve inaktif organik bir kısım. Bu iki inaktif kısım birleşince aktif enzim (holoenzim) meydana gelir (konjuge enzim). Bu nedenle de, enzimler, düşük molekül ağırlığına sahip organik bir moleküle (koenzim) bağlanmış proteinler (apoenzim) olarak ta tanımlanabilirler.
Apoenzim + koenzim ——› holoenzim |
(inaktif) (inaktif) (aktif enzim) |
Koenzimler, apoenzimlerle bazen sıkı bazen de zayıf bağlarla bağlanmışlardır. Koenzimlerin, enzim aktivitesinde önemleri çok fazladır. Enzimlerin etkin bölümünü oluşturan koenzimlerin yapısında vitaminler de (tiamin, riboflavin, niasin, pantotenik asit, folik asit, pridoksin) bulunur. Örn. tiamin (Vit. B1), kokarboksilase koenziminin yapısına giren bir komponenttir. Pantotenik asit, koenzim A (Co-A)'nın; Vit. B1, flavin adenin dinukleotid (FAD)'nin; pridoksal da dekarboksilase ve transaminase'ların bir bölümüdür. Koenzimlerin en önemli görevlerinden biri de, substrattan 2 elektronlu hidrojen çekirdeğini alarak onu okside etmesidir.
02. Enzimlerde Aktif Bölgeler
Son görüşlere göre, substratlar, enzimlerde bulunan ve bu amaç için değiştirilmiş özel bir konfigürasyona sahip bölgelerle (aktif bölgeler) bağlantı kurarlar. Bu bağlantı aynı kilit-anahtar ilişkisi gibidir. Bu aktif bölgeler, öyle özel bir şekilde düzenlemişlerdir ki, kendi kimyasal yapılarına uymayan substratları iterler ve onlarla geçici bileşikler kurmazlar. Aktif yanların bu özelliği, enzimlerin primer yapıları ile ilişkilidir. Substratın, aktif yanlara bağlanması, kısa mesafeden ve kovalent olmayan kuvvetlerle oluşur (iyonik ve hidrojen bağları, Van der Waals kuvveti). Ancak, yukarıda açıklanan ve kilit-anahtar ilişkisi tarzında belirlenen görüş, bütün enzimatik reaksiyonları ifade edecek bir kapsama sahip görülmemektedir. Bu nedenle de, oluşturulan uygunluk teorisi de kullanılmaktadır. Bu görüşe göre, substrat, enzimin aktif yanları ile ilişki kurarken, enzim konfigürasyonunda da değişiklik meydana getirir. Böylece, enzimin, katalitik aktivitesi önemli olan bazı kimyasal grupları substratlarla çok yakın temasa getirerek onları etkisi altına alırlar.
03. Enzimlerin İsimlendirilmesi
Enzimler önceleri bir sistematik gözetilmeden isimlendirilmişlerdir. Pityalin (tükürüğün nişasta sindiren enzimi), pepsin (midenin proteolitik enzimi), tripsin (pankreasın proteolitik enzimi), rennin (dana midesinin süt pıhtılaştıran enzimi), papain (Carcia papaya'nın yaprak ve meyvelerinden elde edilen proteolitik enzim) vs. gibi adlandırılan enzimler buna örnek verilebilir. Sonradan enzimlerin katalize ettiği reaksiyonlar ve etkilediği substratlar esas alınarak isimlendirmeler yapılmıştır. Buna göre, gerek substratların ve gerekse reaksiyonların sonuna "az veya ase" eki getirilerek enzimler adlandırılırlar.
Substratlara göre isimlendirme | Reaksiyona göre isimlendirme |
Substrat | Enzim adı | Reaksiyon | Enzim adı |
Protein | Proteinase | Oksidasyon | Oksidase |
Karbonhidrat | Karbonhidrase | Redüksiyon | Redüklase |
Lipid | Lipase | Dekarboksilasyon | Dekarboksilase |
Üre | Ürease | Hidrolizasyon | Hidrolase |
Enzimler katalize ettikleri reaksiyonlara göre başlıca 6 gruba ayrılmaktadırlar:
Bazı enzimler de sadece proteinden oluşmuşlardır (tripsin, pepsin, ürease gibi). Bunlarda koenzim bulunmaz.
Aşağıdaki çizelgede bazı koenzimler, bulunanların sembolleri ve esas reaksiyonları gösterilmiştir.
| Koenzimler | Sembolleri | Temel reaksiyonlar |
| Adenozin trifosfat | ATP | Fosforilizasyon pirofosforivasyon |
Uridin, sitozin
Guanidin trifosfat | UTP, CTP,GTP | Polisakkarid ve lipid biyosentezinde olduğu gibi aktivasyonlar |
| Nikotinamid adenin dinukleotid (okside olmuş) | NAD+ | Oksidasyon |
| Nikotinamid adenin dinukleotid fosfat | NADP | Oksidasyon |
| Nikotinamid adenin | NADH | Reduksiyon, elektron transport |
| Dinükleotid (redükte olmuş) Flavin adenin
Dinukleotid (okside veya redükte olmuş) Piroksidal fosfat | FAD
FADH2 | Oksidasyon reduksiyon ATP üretimi |
| Pridoksal fosfat | PLP | Dekarboksilasyon deaminasyon transaminasyon |
| Tetrahidrofolik asit | FH2 | 1-karbon bileşiğinin transferi |
(çeşitli formlarda)
Tiamin pirofosfat | TPP | Dekarboksilasyon ketoformasyon |
| Koenzim A (CoA) Biotin | CoA | Karboksilasyon ve karboksil transferi |
04. Kofaktörler
Bazı enzimler hücrede sentezlendikleri zaman genellikle inaktif durumdadırlar (preenzim, zymogen). Bunlar kofaktör veya aktivatör, denen maddeler tarafından aktive edilirler. Örn. trypsinogen, barsakta enterokinase tarafından aktive edilerek trypsin haline (aktif enzim), pepsinogen de midedeki HCl tarafından aktive edilerek (preenzimden, aktiviteyi maskeleyen küçük bir polipeptidin koparılması suretiyle) aktif enzim pepsin haline çevrilir. Bazı enzimler de aktivasyonu için organik olmayan kofaktörlere gereksinim duyarlar. Organik fosfatları hidrolize eden fosfatase enzimi, Mg iyonları tarafından aktive edilir. Kalsiyum, genellikle, proteinaselerin kofaktörüdür. Bunlardan başka, Fe, Zn, Mn, Co, Mol ve Cu 'da aynı şekilde görev yapar. Kofaktörler hücre dışında veya hücre içinde bulunabilir. C. welchii 'nin theta toksini barsakta trypsin tarafından aktive edilirler.
Bazı enzim ve enzimatik reaksiyonlar:
1- Oksido-redüktase'ler: Bu tür enzimler, oksidasyon ve redüksüyon olaylarını katalize ederler.
AH2 + B «=» A + BH2
2- Transferase'ler: Substratların fonksiyonel gruplarının (amino, metil, fosfat, asetil, vs.) transferlerini katalize eden enzimlerdir (tansaminase, transmetilase, transfosfatase, transasetilase, gibi).
AR + B «=» BR + A
3- Hidrolase'ler: Protease, peptidase, lipase, glikosidase, fosfatase, vs. gibi enzimler bu karakterdedirler. Bunlar hidrolizasyon reaksiyonlarını katalize ederek hızlandırırlar.
AB + H2O «=»AOH + BH
4- İsomerase'ler: Bu tür enzimler, optikal konfigurasyonda değişiklik oluştururlar ve katalitik izomerizasyonlarda görev yaparlar (rasemase, epimerase).
AB «=» BA
5- Lyase'ler: Bunlar substratlardan grup çıkarırlar veya grup ilâve ederler.
AB «=» A + B
6- Ligase'ler: İki substratın birleştiği reaksiyonlarda vazife alırlar.
05. Enzim Aktivitesine Etkileyen Faktörler
Hücrelerde çok önemli görev yapan enzimler hücre içindeki, bütün biyokimyasal reaksiyonlarda görev alırlar. Bunların yokluğu veya azlığı durumlarında, hayati öneme haiz olan bu olayların aksamasına ve sonunda hücrenin dejenerasyonuna veya ölümüne yol açar. Enzimlerin aktivitelerine etkileyen başlıca faktörler şöyle özetlenebilir:
1- Kimyasal maddeler: Ağır metaller (Ag, Hg, Cu, Pb) ve bunların tuzları enzimlerin, özellikle, sülfidril (-SH) grupları ile birleşerek aktivitesini bozarlar. Bu tür etkileyen maddeler arasında deterjanlar, fluorid, borat, quinon, formaldehid, hidrojen peroksit, bazik boyalar, asitler, alkaliler, sodyum azid ve diğer maddeler de vardır. Bunlar genellikle kompetatif olmayan tarzda etkinlik gösterirler. Bazı kimyasal maddeler de, normal substrata benzer kimyasal yapıdadırlar ve biyokimyasal reaksiyonlarda, esas substrat yerini alarak enzimle birleşebilirler (kompetatif inhibisyon). Bu durumda esas substrat enzimle birleşemediği için reaksiyonlar bozulur. Örn. suksinik asit ile malonik asit, kimyasal yapı bakımından birbirlerine benzerler ve bu nedenle de enzim, her ikisini birbirinden ayıramaz ve malonik asit, suksinik asit yerine, enzimin spesifik bölgesi ile birleşir.
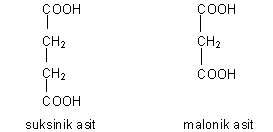
2- Sıcaklık: Enzimlerin aktivitesi sıcaklık ile direk ilişkili olup, sıcaklık yükseldikçe, enzimin katalize ettiği kimyasal reaksiyonun hızı da artar. Ancak, sıcaklık maksimal veya minimal limitlere yaklaşırsa, enzimin aktivitesinde yavaşlama ve sonunda durma meydana gelir. Yüksek ısı, protein karakterinde olan enzimleri koagule ederek çalışmaz hale getirmesine karşın, düşük ısı enzim aktivitesini azaltır ve durdurur. Psikrofilik mikroorganizmaların enzimleri 0-10 °C' ler arasında aktif olmasına karşın, insan ve hayvanlarda hastalık oluşturan mikroorganizmaların (mesofilik) enzim aktivitesi, sıcaklık 45 °C' nin üstüne çıkınca azalır. Termofilik mikroplarda enzimler 50-75 °C' ler arasında aktivitesini korurlar. Sporlar içinde bulunan enzimler 90-100 °C' de ancak inaktif duruma gelirler.
3-pH Limitleri: Bakteri türlerine göre değişmek üzere, enzimler belli pH limitleri (minimal ve maksimal) arasında görevlerini yapabilirler. Ancak, çok asit ve çok alkali ortamlar, enzimlerin çalışması bakımından, genellikle, uygun değildirler. Pepsinin, daha ziyade asit ortamlarda (pH 1.9-2.0) ve tripsin'in ise alkaliye kaçan ortamlarda (pH 8.0) aktivitesi daha iyidir.
4- Substrat konsantrasyonu: Ortamda substratın fazla olması ile enzim aktivitesi arasında bir ilişki vardır. Ancak, bu ilişki devamlı değildir. Eğer, enzim konsantrasyonu sabit ise, belli bir limitten sonra substrat yoğunluğunun artmasının bir yararı olmaz.
5- Enzim konsantrasyonu: Ortamda enzimin fazla veya yeterince olmaması, biyokimyasal reaksiyonların normal gidişinde çok önemli bir faktördür. Enzim yetersizliği hallerinde endergonik ve ekzergonik reaksiyonlarda büyük bozulmalar meydana gelir.
6- Tuz konsantrasyonu: Ortamda fazla madensel tuzların bulunması enzim aktivitesine olumsuz yönde etkiler.
7- Diğer faktörler: Ultraviolet ışınları, proteinlere etkileyen diğer fiziksel ve kimyasal faktörler aynı tarzda enzim aktivitesine de olumsuz yönde tesir ederler.
06. Enzim Aktivitesinin Ölçülmesi
Hücrelerde enzim aktivitesini ölçmek için birçok yöntemler bulunmaktadır. Bunların başlıcaları şunlardır:
1- Spektrofotometrik yöntem: Bu metot yardımıyla, substratın ayrışarak kaybolması veya son ürünlerin ortaya çıkışları araştırılır.
2- Warburg respirometresi: Gaz değişimi oluşturan enzim reaksiyonlarını incelemede ve izlemede kullanılan bir metottur.
3- Thunberg tüpü: Oksidasyon - redüksiyon olaylarını inceleme de yararlanılır. Metilen mavisi okside olunca mavi ve redükte olunca da renksiz bir görünüm verir.
4- Radioizotop yöntemi: Bu teknikle, substrat molekülü içindeki spesifik atomlar radioaktif olarak işaretlendikten sonra enzim reaksiyonuna maruz bırakılır. Oluşan son ürünler radioaktif yöntemle izlenir ve saptanır.
5- Kromatografik yöntem: Enzim reaksiyonları sonu oluşan son ürünler çeşitli kromatografik yöntemlerle analizlere tabi tutularak incelenirler.
07. Bakteri Enzimlerinin Karakterleri
Bakteri enzimleri başlıca iki genel bölüm altında incelenebilirler.Bunlar da:
1) Ekstrasellüler enzimler (ekzoenzimler): Bu enzimler hücre içinde sentezlendikten sonra dışarı salınarak buradaki gıda moleküllerinin ayrışmalarını ve hücre duvarından geçebilecek düzeye inmelerini katalize ederler. Bu tarz aktivite gösteren enzimler (hidrolitik enzimler) arasında, başlıca, proteinase'ler (peptidase, jelatinase, kollajenase, kazeinase, fibrinolizin, vs), karbohidrase'ler (sellülase, amilase, maltase, laktase, sukrase, hıyalurinidase, vs) ve lipase'ler, nuklease ve diğerleri bulunmaktadır. Bakteriyel toksik substansların bir kısmı da enzim özelliği taşırlar.
2) İntrasellüler enzimler: Bu tür enzimler de hücre içinde sentezlenmelerine karşın, dışarı çıkmayarak burada dissimilasyon ve assimilasyon reaksiyonlarında etkinlik gösterirler. Endoenzim olarak ta tanımlanan bu özellikteki enzimler arasında, başlıca permease'ler (sitoplasmik membranda bulunurlar ve aktif transportta etkinlikleri vardır, beta galaktosidase gibi), hidrolase'ler (hücre içinde hidrolitik reaksiyonlarda görev yaparlar), oksidoredüktase'ler (hücre içinde oksidasyon redüksiyon olaylarında elektron transferini katalize ederler), transferase'ler (karbonhidrat metabolizmasında ve yüksek enerjili fosfat bağlarının kurulmasında fonksiyonları vardır), DNA polimerase (DNA'nın replikasyonunda), RNA polimerase (DNA iplikçiklerinin birinden mRNA'nın meydana gelmesini katalize eder), nuklease (DNA ve RNA'ların ayrışmasında), restriksiyon endonuklease (DNA üzerinde belli baz aralıklarından kesmeler yapar), DNA ligase (DNA'daki kopmaları tamirde ve birleştirmede fonksiyonu vardır), peptidil transferase (iki aminoasit arasında peptid bağlarının kurulmasını katalize eder) ve bunlardan ayrı olarak, sayıları 100'leri geçen diğer fonksiyonel enzimler bulunmaktadır.
Yukarıda bildirilen, görev yerlerine ve fonksiyonlarına göre sınıflandırılan enzimlerin bazıları devamlı kullanıldıkları ve hücre dışına salındıkları için kesintisiz olarak sentezlenirler. Bunlar aynı zamanda hücrenin bulunduğu ortamla bir ilişkisi yoktur. Devamlı salgıladıkları için hücrenin bir parçası olarak kabul edilen bu enzimlere yapısal enzimler adı verilir. Ekzoenzim ve endoenzimlerin büyük bir kısmı böyle bir özelliğe sahiptir. Bazı enzimler de devamlı sentezlenmeyip ortamda, bunun sentezini indükleyecek bir substratın bulunması gerekmektedir. İndüklenebilen enzimler olarak tanımlanan bu enzimler, ortamdan substarat kaldırılırsa veya tükenirse, bunların sentezleri de durur. Örneğin, bileşiminde laktoz bulunan besi yerinde E. coli üretilirse, bunu parçalayan beta-galaktosidase enzimini sentezlenir. Laktoz ayrışıp bitince bu enzimin sentezi de sona erer.
Bakteriyel enzimlerin bazıları, lipopolisakkarid membranda (reseptör görevi yapan proteinler, fosfolipase A ve lizofosfolipase, vs), periplasmik aralıkta (transmembran transportta ve kemotaksisde görev alan, elektrolit bağlayan enzimler, fosfotase ve esterase,vs) ve sitoplasmik membranda (hücre duvarının sentezinde fonksiyonel enzimler, proton translokasyonu, ATPase ve bazı elektron-transfer proteinleri permease'ler vs.) lokalize olmuşlar.
08. Enzim Sentezinin Regulasyonu
Mikroorganizmalarda enzim sentezinin kontrolü başlıca iki mekanizma tarafından regüle edilir. Bunlardan biri indüksiyon (enzim sentezinin uyarılması) ve diğeri de represyondur (enzim sentezinin baskılanması). Her nekadar bu iki aktivite birbirine ters gibi görünürlerse de, genellikle, canlıların yaşamında her ikisinin rolü ve etkinliği oldukça önemlidir.
İndüksiyon da, ortamda özel indüktörlerin bulunduğu durumlarda enzimlerin sentezi veya salgılanması işlevi meydana gelmektedir. Özellikle, indüklenebilen enzimler (beta-galaktosidase, beta galaktoside permease, vs.) buna iyi örnek oluştururlar.
Represyonda regulatör bir protein olan represörün korepresörle birleşerek oluşturduğu aktif kompleksin DNA'da bulunan operatör gen bölgesine bağlanması ve böylece genin fonksiyonu önlenerek mRNA sentezinin baskılanması sonu enzim sentezi de gerçekleşemez. | 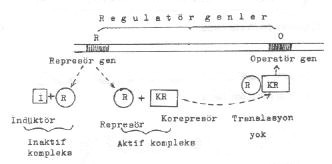
|
Represyon başlıca 2 tarzda meydana gelebilmektedir.
1) Son ürün inhibisyonu (Feedback represyonu): Birçok bakteri (Örn. E. coli) ürediği ortamda metabolik aktivite sonu bazı son ürünlerin oluşması (amino asitler gibi), enzimin aktivitesi üzerine olumsuz yönde etkileyerek, enzim sentezini durdurabilir. Eğer, son ürünler azalır ve minimal düzeye inerlerse etkinlikleri de kaybolur ve bu zaman enzim sentezi tekrar başlar (derepresyon). Örn., E. coli, minimal besi yerinde (arginin olmayan) üretilirse arginin biyosentezi normal olarak yürütülür. Eğer, besiyerine arginin 20 µg/ml olacak tarzda katılırsa enzim (Ornithin Carbomoyl Transferase) sentezi deprese olur. Böyle besi yerinden çıkarılan E. coli 'ler yıkandıktan sonra (argininden kurtarılırsa) minimal ortama ekilirlerse tekrar arginin biyosentezi gerçekleşebilir ve ortamda enzim konsantrasyonu artmaya başlar.
Glutamat —› Ornitin —› Citruline «=» Arginin (son ürün)
2) Katabolik represyon: Eğer, E. coli 'ler, içinde hem glikoz ve hem de laktoz (veya, glikoz+sorbitol; glikoz+asetat) bulunan bir besiyerine ekilirse, önce glikoz kullanılır ve laktoz ayrıştırılmaz. İki substrat aynı anda katabolize edilemez ve genellikle, tercihen glikoz metabolize edilir: Eğer ortamda glikoz ayrışır ve biterse bu defa ikinci substrat kullanılmaya başlar. Burada, ikinci subsratı ayrıştıracak olan enzim ilk aşamada inhibe edilerek sentezi önlenir. Bu tarz inhibisyon "katabolik represyon" olarak tanımlanır.
1 Kaynak: Temel Mikrobiyoloji