Rekombinant Faj Antikor Tekniği (RFAT)
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji 1
01. Genel Bilgiler
02. Rekombinant Faj Antikor Tekniğinin Avantajları
03. Rekombinant Faj Antikor Tekniğinin Aşamaları
01. Genel Bilgiler
Gerek prokaryotik ve gerekse ökaryotik organizmalara ait değişik proteinleri kodlayan genler, çeşitli vektörler (faj, plasmid, cosmid, fajmid, virus, bakteri, vs.) yardımıyla, mikroorganizmalarda (genellikle, bakterilerde, basillerde, vs.) ve/veya ökaryotik hücrelerde başarı ile klonlanmış ve genlerin ekspresyonu sağlanmıştır. Kuşkusuz, bunlar arasında, ökaryotiklere ait immunglobulin genleri de bulunmaktadır. Ancak, bugüne kadar, tam ve fonksiyonel bir İg geni klonlanamamış sadece, ağır zincirin Fc-porsiyonu veya sadece ağır veya hafif zincirlerin bir bölümü klonlanabilmiştir. Çünkü, tam bir immunglobulin geni, tek bir DNA sekansı halinde bulunmayıp ayrı ayrı genlerin reorganizasyonu sonu oluşabilmektedir. Dolayısıyla de bu genlerin hepsini bir arada elde etmek mümkün olamamaktadır.
Son teknikler, antikor molekülleri arasında da rekombinant teknikleri yardımıyla bazı kimerik moleküllerin elde edilmesine olanak sağlamıştır. Spesifik bir antikor molekülünün homolog immunojenle birleşebilen kısmı, immunglobulinin Fab (Fragment antigen binding) bölgesinde bulunan VH (variable heavy) ve VL (variable light) zincirleridir. Bunlardan VH, ağır zincirin amino terminal (NH2) ucundan ve VL'de hafif zincirin yine aynı ucundan itibaren yaklaşık 110 amino asitlik (M.A.22.500) bölgesini kapsarlar. Geri kalan kısımlar ise sabit (konstant) bir amino asit dizisine sahiptirler. Fonksiyonel bir spesifik immunglobulinin, homolog antijenle etkin bir tarzda bağlanabilen VH ve VL kısımları, molekülün CH1 ve CL kısımlarından enzimatik olarak kesilerek çıkarılırsa elde edilen sadece VH ve VL kısımları yine antijenle bağlama etkinliğini devam ettirir. Ancak, molekülün geri kalan kısımlarına ait biyolojik aktivitelerin sahip olamaz. Eğer, bu dezavantaj göz ardı edilirse ve antijen-antikor ilişkisi ön plana alınırsa, sadece, VH ve VL bölgelerinin aktivitesi de yeterli olabilmektedir.
Bir Ig’de ilmek bölgeler yandaki şekilde gösterilmektedir. | 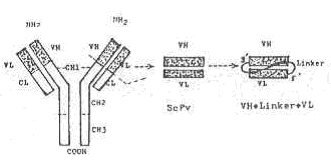
|
ScFv DNA sekansı ile pCANTAB 5’in birleştirilmesi yandaki şekilde gösterilmektedir. | 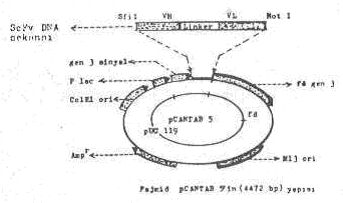
|
Enzimatik olarak İg molekülünden ayrılmış olan, VH ve VL kısımları bir arada tutulabilmek ve bir bütün halinde fonksiyonunu tam olarak sağlamak için, her iki zincir birbirlerine doğal peptid linkerlerle (Gly4Ser3) bağlanarak bu iki kısa tek zincir birleştirilir (ScFv: Single chain fragment variable) ve böylece molekülün etkinliği artırılır. Bu linker yaklaşık 15 amino asitten oluşmakta ve VL'ın 5'-amino terminal ucu ile VH'in 3'-karboksi terminal ucu arasındaki 3.5 nm uzunluğundaki aralığı doldurmaktadır. Bu tarzda hazırlanan molekülün stabilitesi ve afinitesi, antijenle bağlanma yönünden, doğal antikor molekülününkine eşittir. Bu yöntem, aynı zamanda, başka immunojenlere karşı hazırlanmış antikorların VH ve VL bölgelerini veya başka hayvanlardan elde edilen ve aynı immunojene karşı oluşan İg'lerin VH ve VL kısımlarını birleştirme olanağını sağladığı gibi, tam bir ağır veya hafif zincirleri de benzer tarzda değiştirebilme imkânını verebilmektedir (rekombinant antikor, bispesifik antikor, kimerik antikor).
Rekombinant antikor üretimi yandaki şekilde gösterilmektedir. | 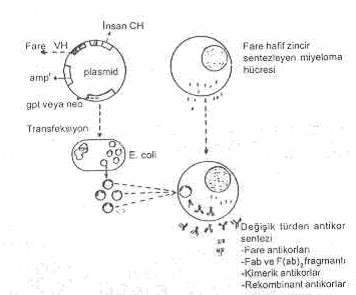
|
Yukarıda bahsedilen rekombinant antikor elde etme tekniğinin sonuçlarından yararlanılarak rekombinant faj antikor teknolojisi (RFAT) geliştirilmiştir. Ancak, bu son yöntem monoklonal antikor (MKA) elde etme prosedürüne alternatif olarak kabul edilmekte ve MKA teknolojisine bazı üstünlükleri de bulunmaktadır.
Bu tekniğin esasını, antikor fragmentlerini (Fv= VH + VL bölgelerini) bir fajmid vektör yardımıyla bakteride klonlamak ve üreyen fajların yüzeyinde VH + VL moleküllerinin, bir füsyon proteini olarak, ekspresyonunu sağlamak, oluşturmaktadır. Burada, faja (M13) ait g3p proteinine bağlanmış olarak elde edilen antikor molekülü (VH + VL), spesifik antijenle birleşme özelliği taşır.
Bu teknoloji ile elde edilen antikorları, insan ve hayvanlardaki bir çok hastalıkların epidemiyolojisi, pasif bağışıklık, serodiagnozis ve seroterapisinde kullanma olanağı olduğu gibi, bir çok araştırmada da yararlanma için yeni ufuklar açmaktadır.
02. Rekombinant Faj Antikor Tekniğinin Avantajları
1) Rekombinant faj antikorların (RFA) üretimi daha kolaydır. Buna karşın MKA’ ın (monoklonal antikorlar) üretimi zaman alıcı ve yorucudur. Spesifik antikor genleri kolaylıkla dalak hücrelerinden elde edilebilir. Bu durum zamandan ve emekten büyük tasarruf sağlar.
2) RFA 'lar daha çabuk ve ekonomik olarak üretilebilirler. Çok fazla miktarda faj antikorları, bakteri kültürlerinden bir gecelik inkubasyon sonunda, elde edilebilirler.
3) RFA 'larının üretimleri için, deneme hayvanlarına veya çok fazla miktarda hücre kültürlerine gereksinim yoktur. Halbuki, MKA 'ları fazla üretmek için hayvanlardan asites elde edilmesine veya hibridomaların büyük şişelerde hücre kültürlerinin yapılmasına ihtiyaç vardır.
4) RFA teknolojisi daha güvenilir ve stabil genetik kaynaklar sağlar. Halbuki, hibridomalarda bazen antikor sentezi azalabilir veya durabilir. Kimi hibridomlar da, çekirdek kaybederek genetik olarak güvensizlik oluşturabilirler.
5) Faj antikor genleri üzerinde her türlü genetik manipulasyonlar (sekans analizleri, mutasyonlar, vs.) yapmak olanak dahilindedir.
03. Rekombinant Faj Antikor Tekniğinin Aşamaları
1) Antikor sentezleyen hibridomalar veya immunize edilmiş farelerin dalaklarından sağlanan B-hücreleri (veya plasma hücreleri) içinden, immunglobulin molekülünün ağır ve hafif zincirlerine ait mRNA'lar ayrı ayrı izole edilerek pürifikasyona tabi tutulurlar. Antikor kolanlanmasının ilk adımını ve başarısını bu pürifikasyon sağlar. Ayrıca, hibridomaların veya B-hücrelerinin ve antikor sentezleme durumları, klonlamadan önce, iyice kontrolden geçirilmelidir. Pürifikasyon için afinite kromatografi tekniğinden yararlanılabilir.
2) Saf olarak elde edilen ağır ve hafif zincirlere ait mRNA' lardan revers transkriptaz enzimi yardımı ile tek iplikçik cDNA 'lar (komplementer DNA) sentezlenirler.
Bu amaçla, mRNA'ların 3'-uçlarına poli A(AAA....A) nukleotidleri ve bunların karşılarına da poli T(TTT...T)'ler sentezlenirler. Bu poli T 'ler polimerizasyon için bir basamak oluştururlar. Bundan sonra revers transkriptaz enzimi ile mRNA 'lara tek iplikçik komplementer DNA'lar sentezlenir.
Antikor sentezleyen bir B hücresinden ağır ve hafif zincir mRNA ‘larının çıkarılması, cDNA ‘ya çevrilmesi, ağır ve hafif zincir genlerinin izolasyonları ve PZR aşamaları yandaki şekilde gösterilmektedir. | 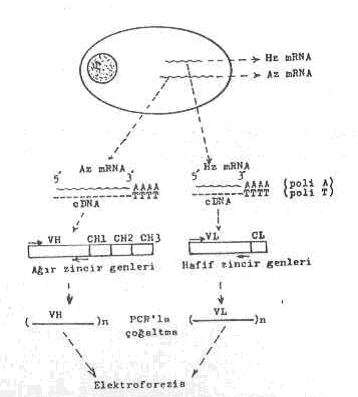
|
3) Her iki cDNA üzerindeki VH ve VL genleri için ayrı ayrı primerler hazırlanarak PCR tekniği ile amplifiye edilirler (30 kez çoğaltılır).
4) Amplifiye edilen VH ve VL zincir fragmentleri ayrı ayrı, agarose jel elektroforezise tabi tutularak pürifiye edilirler. Böylece, primerler ve diğer eksternal amplifiye ürünlerden kurtarılmış olurlar. Oluşan bantlar Ethidium bromide ile boyanarak görünür hale getirilir. Amplifiye edilen bantlar, agarose jelden kesilerek çıkarılır ve pürifiye edilirler .
5) VH ve VL gen sekansları, DNA linkerleri kullanılarak birleştirilir ve böylece tek iplikçik DNA fragmenti elde edilir. Linker, VH gen sekansının 3'-ucu ile VL gen sekansının 5'-ucu arasını birleştirir. Oluşan bu tek iplikçik molekül 700 baz çifti uzunluktadır (ScFv DNA fragmenti: Single chain fragment variable).
Elektroforeziste separasyon, VH ve VL gen sekanslarının çıkarılması, PZR ile amplifikasyonları, linker ilavesi ve linkerlerin VH ve VL genlerinin birleştirilmesi yandaki şekilde gösterilmektedir. | 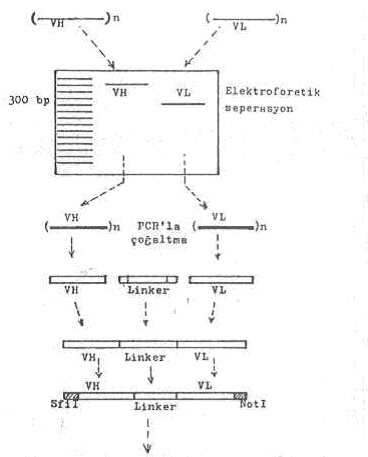
|
6) Elde edilen bu son molekül (VH + linker + VL), tekrar PCR tekniği ile, oligonukleotid primerler kullanılarak, amplifiye edilir (30 kez). Bundan sonra VH'in 5'-ucunda Sfil için ve LV'nin de serbest ucunda (3') NotI restriksiyon enzimleri için kesim yerleri (spesifik linker) ilave edilir.
7) Ortamdaki bağlanmamış, artan linkerleri, dNTP ve Taq polimeraz, vs. gidermek için tekrar bir pürifikasyona tabi tutulur (Spun kolum pürifikasyon).
8) Uçlara ilave edilen spesifik linkerler, ayrı ayrı Sfil ve NotI restriksiyon enzimlerin ilavesi ile kesilerek yapışkan uçlar meydana getirilir.
VH+Linker+VL sekansının iki ucunun Sfil ve Notl ile kesilmesi , pCANTAB 5 plasmidi ile birleştirilmesi, E. coli ‘ye transfer ve koloni seleksiyonu yapılması yandaki şekilde gösterilmektedir. | 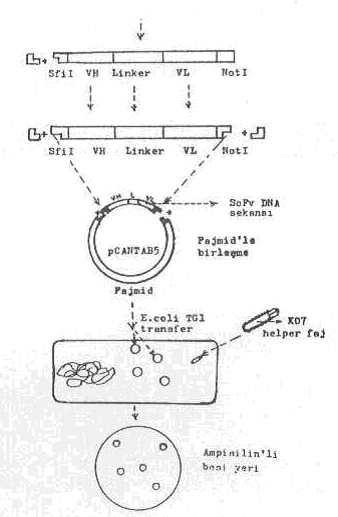
|
9) Antikor tek iplikçik DNA fragmenti (ScFv), fajmid vektör (pCANTAB5) ile birleştirilir. Ancak, bu vektör de önceden Sfil ve NotI'le kesilerek iki tane komplementer yapışkan uç meydana getirilir ve öylece ScFv ile bileşmesi kolaylaştırılır. İki yapışkan ucun birleşmesinde DNA ligazdan yararlanılır.
10) Hazırlanmış olan ScFv DNA sekansı ile fajmid kimerik molekülü, kompetent E.coli TG1 suşuna transfer edilir ve E. coli TG1 suşu, içinde CaCl2 glikoz ve ampisilin bulunan ortamda 30°C'de inkube edilir (transfer için elektroporasyon tekniği de kullanılabilir). Bu ortamda sadece pCANTAB5 taşıyan E.coli TG1'ler ürer. Çünkü, fajmid de ampicillin dirençlilik geni bulunmaktadır.
11) Fajmid taşıyan E.coli TG1 kolonileri M13K07 helper fajı ile infekte edilir. Bakteriye transfer edilen rekombinant molekül (ScFv-DNA sekansı + pCANTAB5 fajmid) hücre içinde, sentez edilmeye başlar. Bu sırada faj replikasyonu da başlar, tam faj molekülleri oluşarak bakteri hücresinden dışarı çıkarlar. Dışarı çıkan ve içinde ScFv-gen sekansı taşıyan faj partiküllerinin yüzeyindeki g3p proteinine bağlı olarak bir veya birkaç antikor eksprese edilir.
ScFv taşıyan K07 fajı yandaki şekilde gösterilmektedir. | 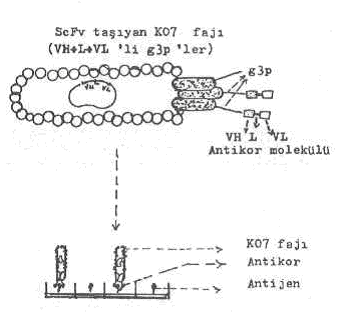
|
12) Bakteriden dışarı çıkan fajların ucunda antikor molekülünün varlığı, immunolojik yöntemlerle (ELISA, vs) kontrol edilir. Bağlanamayan faj veya antikorlar, sistem yıkanarak, giderilir.
13) Ucunda antikor molekülü taşıyan fajla, E. coli TG1 tekrar infekte edilir ve katı ortama ekilir. Koloniler alınarak saf olarak üretilir ve fazla miktarda antikor taşıyan faj partikülleri elde edilir. Fajmid de tek iplikçik M13'e ve çift iplikcikli plasmide ait replikasyon orijini bulunur.
[1] Kaynak: Temel Mikrobiyoloji