Tümör Virusları (Onkoviruslar) ve Viral Onkogenezis
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji 1
01. Genel Bilgiler
02. Sellüler Protoonkogenler ve Onkogenler (c-onc)
02.01. Protoonkogenler ve Sellüler Onkogenler (c-onc)
02.02. Tümör Süpresör Genler (Antionkogenler, Onkosüpresör Genler)
03. Protoonkogenlerin Aktivasyonları (Viral Ve Nonviral Mekanizmalar)
04. Viral Onkogenler (v-onc)
05. Multistep Onkogenezis
06. Tümör Hücre Onkogenleri
07. Hücre Transformasyonları
08. Tümör Virusları (Onkoviruslar)
08.01. RNA Tümör Virusları (Onkornaviruslar)
08.02. DNA Tümör Virusları Ve Onkogenezis
01. Genel Bilgiler
Tümörler, hücrelerin normal büyüme, üreme ve gelişmelerini ve aynı zamanda bu fonksiyonların kontrollerini ve regulasyonlarını sağlayan proteinleri kodlayan genlerde (protoonkogenler ve tümör supresör genler) oluşan genetik düzeydeki değişmeler (mutasyonlar) sonucunda meydana gelirler. Bu varyasyonlar, protoonkogenlerin aşırı aktivasyonuna ve buna bağlı olarak ta aşırı ekspresyonlarına yol açarak bu normal ve önemli genlerin, sellüler onkogenler (c-onc) haline dönüşmesine, bunun sonucunda hücrelerin üremelerini stimule eden fazlaca ankoprotein sentezine yol açarak kontrol edilemeyen ve dolayısıyla da devamlı ve sınırsız hücre üremelerine (tümör formasyonu) sebep olurlar.
Protoonkogenler ile tümör supresör genler (antionkogenler), tek bir faktörün etkisinden ziyade, bir kaç nedenin (multifaktöriyel) birlikte ve ardışık tesiri altında mutasyonlara maruz kalarak tümör oluşumuna yol açtıkları belirtilmektedir. Bu nedenle de tümörler uzun bir süre içinde gelişebilmektedirler. Genetik değişiklikler, somatik hücrelerin genomlarında olduğu kadar eşey hücre genetik materyallerinde de görülebilir ve yeni nesillere aktarılabilirler (vertikal transfer).
Günümüzde, tümörigenezisi aydınlatmak için bazı görüşler ileri sürülmüştür. Bunlar arasında başlıca: somatik mutasyonlar, kronik irritasyonlar, multifaktöriyel ajanlar, multistep gelişmeler, viral ajanlar, monoklonal ve immunolojik teoriler ve diğerleri yer almaktadırlar. Ancak, bu görüşlerin çoğu, tümörigenezisin gerçek nedenini ortaya koymaktan ziyade, onkogenezise yardımcı ve hazırlayıcı faktörleri kapsamaktadır. Şöyle ki; onkogenezisde immun yetmezliğin immunsupresif ilaç kullanmanın, immun sistem aktivitesi noksanlığının ve benzer olumsuz etkilerin kanserin gelişmesinde ve ilerlemesinde çok önemli rolleri bulunmaktadır. Özellikle, lenfoid (B-hücre, T-hücre, CTL; NKC; LAKC) ve miyeloid sisteme ait hücrelerde (makrofaj, polimorfnukleer lökositler ve diğerleri) oluşan konjenital ve/veya edinsel immun yetmezliklerde, vücudun humoral ve sellüler savunmasında çok önemli aksaklıklar ve bozukluklar meydana gelmektedir. Ayrıca, sitokin sentezinin çok zayıf, yetersiz olması veya sentezlenememesi, tümöre karşı reaktif olan hücrelerin zayıf bir etkinlik göstermesine (veya hiç etkin olamamasına) yol açacağından tümörlerin gelişmesi ve ortaya çıkmaları daha kolaylaşmaktadır.
Neoplazmaların bilinen klasik, fiziksel ve kimyasal nedenleri arasına, son yıllarda viruslar da (onkoviruslar, biyolojik faktörler) katılmış bulunmaktadır. Bazı spesifik viruslar tarafından yeni doğan farelerde, tümörlerin oluşturulması, in vitro hücre kültürlerinde transformasyonların meydana getirilmesi veya in vivo gelişen tümör hücrelerinde virus partiküllerine rastlanılması ve bunlardan izole edilen viruslarla in vitro transformasyonlar ve in vivo tümörlerin oluşturulması, onkogenezisde virusların önemli rolleri olduğunu ortaya koymaktadır. Ancak, şu noktayı da belirtmekte yarar bulunmaktadır. O da, onkovirusların çoğu, konakcı hücre DNA'sına integre olduklarından, elektronmikroskopla muayenelerde viruslara rastlanmayabilir. Bu durum, o tümörün bir virus tarafından oluşturulmadığını göstermez.
Protoonkogenlerin, çeşitli karakterdeki mutasyonlarla, değişerek aşırı aktive ve eksprese olmasına ve bunların sellüler onkogenler (c-onc) haline dönüşmesine ve bunların aynı zamanda onkoprotein sentezine yol açan başlıca faktörler, aşağıda kısaca belirtilmiştir.
I) Fiziksel Faktörler
a) İyonizan radyasyonlar (X-ışınları, gama ışınları, radyoaktif izotoplar ve diğerleri)
b) Non iyonizan radyasyonlar (UV-ışınları, güneş ışınları ve diğerleri)
c) Fiziksel travmalar ve kronik irritasyonlar
II) Kimyasal Faktörler
a) Polisiklik aromatik hidrokarbonlar (Benzo (a) pyrene, dimethylbenzanthracene, vd.)
b) Aromatik aminler (2-acetylaminofluorene, N-methyl-4-aminoazobenzene (MAB), vd.)
c) Çeşitli ilaçlar (Alkilanlar "cyclophosphamide", diethylstilbestrol)
d) Nitrosaminler (Dimethylnitrosamine, diethylnitrosamine)
e) İnorganik bileşikler (Arsenik, asbestos, beryllium, cadmium, chromium, vd).
f) Doğal bileşikler (Dactinomycin, aflatoksinler, vd)
III) Biyolojik Faktörler
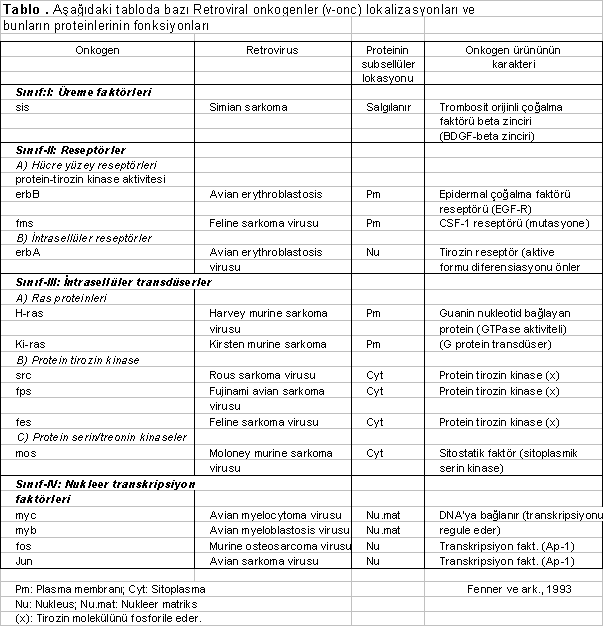
a) RNA virusları (Retroviruslar tip-B ve -C)
b)DNA virusları (Adenoviruslar, hepadnaviruslar, herpesviruslar, papovaviruslar, parvoviruslar, poxviruslar)
IV) Genetik Faktörler
Ailede, genetik yönden tümör oluşumuna kalıtsal bir eğilimin bulunması
V) Predispozan Faktörler
İmmun yetmezlik hastalıkları, immunsupresif ilaçların kullanılması, yaşlılık, hormonlar, beslenme alışkanlıkları, sigara, mesleki durumlar, yaşam tarzı, vd.
02. Sellüler Protoonkogenler ve Onkogenler (c-onc)
Hücrelerin normal ve önemli genleri arasında bulunan, hücrelerin üreme ve gelişmelerini sağlayan ve bunları kontrol veya regule eden başlıca iki temel gen grubu bulunmaktadır.
Bunlarda,
1) Protoonkogenler ve sellüler onkogenler (c-onc)
2) Tümör supresör genler (antionkogenler, onkosüpresör genler)
02.01. Protoonkogenler ve Sellüler Onkogenler (c-onc)
Protoonkogenler, normal hücrelerin genleri arasında yer almakta ve çok önemli fonksiyonlara sahip bulunmaktadırlar. Protoonkogenlere, hemen hemen bütün canlıların genomlarında rastlanılması, bunların temel genler arasında yer aldıklarını ve çok titizlikle korunduklarını açıkça ortaya koymaktadır. Bu durum da, bu genlerin, çok önemli olduğunu göstermektedir.
Normal (fizyolojik) koşullar altında, protoonkogenler başlıca dört önemli proteinin (onkoprotein) sentezini yöneten kodlara (informasyonlara) sahip bulunmaktadırlar.
1) Büyüme (çoğalma) faktörleri: Polipeptid karakterinde olan bu faktörler hücre DNA'sını (kromozom) uyarmada etkin fonksiyonlara sahiptirler. Hücrelerin genomlarında lokalize olan bu protoonkogenler, eğer retroviruslardaki (oncornaviruslar) çok kuvvetli promotor/güçlendirici (enhenser) sekanslarının (LTR, long terminal repeat) kontrolü altına girerlerse, çok fazla uyarılır ve aşırı eksprese (transkripsiyon ve translasyon) olurlar. Bu stimulasyon sonunda, devamlı olarak çoğalma faktörleri (onkoproteinler) sentezlenerek hücrelerin normalinden çok fazla, kontrolsüz ve sınırsız üremelerine ve bu durum, devam ettiği takdirde onkogenezise yol açarlar. Fibroblast hücre kültürlerinde yapılan in vitro çalışmalarda, üreme (çoğalma) faktörü sentezinin artması fibroblastların fazla çoğalmasına ve ölümsüz hücrelerin oluşmasına (immortalizasyon) sebep olduğu ortaya konulmuştur. Viral sekansların, protoonkogenlerin 5'-terminusuna yakın veya bitişik olarak yerleşmesi, bu genin (protoonkogenin) aşırı uyarılmasını ve eksprese olmasını çok kolaylaştırır. Böylece, LTR'ler, RNA polimeraz enziminin aktivitesini güçlendirmiş ve arttırmış olurlar.
Bu sentezlenen üreme faktörleri, hücrelerin yüzeyinde lokalize olan çoğalma faktör reseptörlerine bağlanarak hücreleri uyarırlar.
Protoonkogenlerin aktivasyonları için sinyal transdüksiyon akış aşamaları yandaki şekilde gösterilmektedir. | 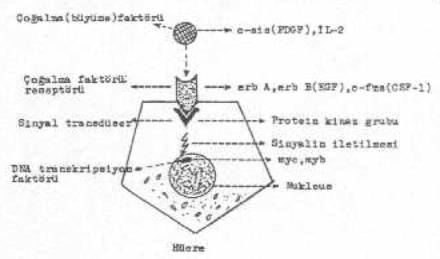
|
2) Çoğalma faktör reseptörleri: Hücreler tarafından sentezlenen çoğalma faktörlerinin etkin olabilmeleri için, bunların hücre yüzeyindeki özel reseptörlere (çoğalma faktör reseptörleri) bağlanması ve taşıdıkları çoğalma sinyallerini, reseptörler aracılığı ile hücre içine transfer etmeleri gereklidir. Bu reseptörlerin hücre içi uzantıları, aldıkları veya kendilerine iletilen transmembran uyarıları, intrasellüler transdüserlere aktarırlar.
Hücreler tarafından sentezlenerek membranda lokalize olun bu reseptörler de çeşitli strüktürel mutasyonlar meydana gelirse, onkogenlere dönüşebileceği bazı araştırıcılar tarafından belirtilmiştir. Şöyle ki, viral erbB (v-erbB) genleri, onkogeninin ekstrasellüler ligand bağlanma bölgesi olmayan epidermal çoğalma faktörü reseptör geni olduğu bildirilmiştir.
İntrasellüler reseptörler arasında kabul edilen bu tür moleküllerden v-erbA gen ürünleri bir tirosin reseptörü olup, bunun aktive olmuş formu diferensiasyon önleme yeteneğine sahiptir. Modifiye olmuş reseptör ErbA, endojenik tiroid hormon reseptörü ile kompetasyonu sonu, kontrolsüz bir çoğalmaya neden olur. Avian erythroblastosis virus (AEV) infeksiyonunda hem v-erbA ve hem de v-erbB genleri sinergetik bir tarzda etkilenerek onkojeniteye yol açarlar.
3) Sinyal transfer faktörleri (intrasellüler transdüserler): Bu moleküller, reseptörlerden aldıkları çoğalma sinyallerini hücre çekirdeğine veya hücresel hedef bölgelere iletmede önemli rol alan spesifik proteinlerdir. Bunları, kodlayan genler arasında en iyi tanımlanan Ha-ras ve Ki-ras onkogenleri bulunmaktadır. Ekseri ras molekülleri istirahat halindeki hücrelerde inaktif bir durumdadır. eğer bunlar, reseptörlerden gelen transmembran sinyaller yardımı ile uyarılırsa, guanosin trifosfat sentezine yol açarlar (ras molekülleri hücre içinde, genellikle, guanosin difosfat ile bileşik oluştururlar). Fosforilize olmuş bu proteinler, ikincil mesenger görevi yaparak sinyallerin kromozoma transferini sağlarlar.
Bu grupta bulunan onkogenlerin ekserisi trozin kinaz proteinin kodlarına sahiptirler. Onkogen kinazlar hedef proteinlerini hem tanımada ve hem de fosforile etmede önemli fonksiyonlara sahiptirler.
4) Nükleer transkripsiyon faktörleri: Bütün onkogenler, bir veya birkaç mekanizma ile (direkt veya indirekt yollarla) hücre nukleusunda bazı değişiklikler oluştururlar. Bu grupta bulunan onkogenler ise, direkt olarak ya transkripsiyona etkilerler veya DNA'ya bağlanırlar. Örn, v-jun onkogeni, AP-1'in çok yakın homoloğudur. AP-1, bir transkripsiyon faktörü geni olup diğer bir nükleer onkoprotein olan Fos'a kuvvetlice bağlanır.
Jun onkogeni, transkripsiyonal regulatör fonksiyonu nedeniyle tümör oluşumunu indükleyebilir. Fosfoprotein kodlayan genler arasında yer alan myc, myb ve fos genleri, diğer genleri transaktive edebilir ve bunun sonunda DNA'yı stimule ederek, direkt veya indirekt olarak, replikasyonu başlatabilir. Oluşan yapısal veya regulatör değişiklikler tümör gelişimini artırır.
-Genoma (kromozomlara) ulaştırılan transmembran sinyaller, DNA'nın aşırı uyarılmasına ve aşırı ekspresyonuna yol açarlar.
-Transdüserler hücre tarafından sentezlenerek sitozol içinde depolanırlar ve gerektiği zaman ve yerde görev yaparlar.
-Onkogenler, yapısal ve görevsel olarak birbirlerinden az çok farklıdırlar.
-Şimdiye dek 100'den fazla onkogenin varlığı bildirilmiştir.
-Onkogenlerin kodladığı proteinler (onkoprotein), normal protoonkogenlerin proteinlerinden bazı farkları bulunmaktadır. Bunlar a) Onkoproteinler, çok önemli olan regulatör proteinlerden yoksundurlar. b) Onkoproteinler, diğer eksternal sinyallere bağımlı değildirler ve c) V-onc'larda intron yoktur.
-Nonviral orijinli tümörlerde de, protoonkogenler benzer etkinlik gösterirler. Şöyle ki , böyle bir özellik gösteren tümör hücrelerinden ekstre edilen DNA'ların in vitro fare fibroblast hücrelerinde transformasyonlar oluşturması, tümör hücrelerinde onkogenlerin varlığını ortaya koymaktadır.
02.02. Tümör Süpresör Genler (Antionkogenler, Onkosüpresör Genler)
 Son yıllarda yapılan ayrıntılı ve moleküler düzeydeki çalışmalarda, normal hücrelerde üremeyi ve hücrelerin gelişmelerini negatif olarak kontrol ve regule eden ayrı ve önemli fonksiyona sahip genlerin varlığı ortaya konulmuştur. Bu genlerin kodladığı proteinler, protoonkogenlerin sentezlerini spesifiye ettikleri proteinlerin görevlerini kontrol ederek, bunların normal limitler içinde etkinlik göstermelerini sağlarlar ve protoonkogenlerin aşırı uyarım ve ekspresyonlarını önlerler. Böyle aktivite gösteren özel genlere tümör supresör genler (onkostatik genler, antionkogenler veya üreme supresör genleri) adları verilmektedir. Eğer bu genlerde mutasyonlar ortaya çıkarsa, bunların inaktivasyonuna veya normal fonksiyonlarının bozulmasına yol açarak kodladıkları regulatör proteinlerin de non fonksiyonel olmalarına neden olur ve kontrol mekanizması işleyemez hale gelir. Bu olgunun sonunda, protoonkogenlerin devamlı üreme proteinleri sentezleri nedeniyle hücreler sınırsız ve kontrolsüz ürerler ve tümör gelişimine sebep olurlar.
Son yıllarda yapılan ayrıntılı ve moleküler düzeydeki çalışmalarda, normal hücrelerde üremeyi ve hücrelerin gelişmelerini negatif olarak kontrol ve regule eden ayrı ve önemli fonksiyona sahip genlerin varlığı ortaya konulmuştur. Bu genlerin kodladığı proteinler, protoonkogenlerin sentezlerini spesifiye ettikleri proteinlerin görevlerini kontrol ederek, bunların normal limitler içinde etkinlik göstermelerini sağlarlar ve protoonkogenlerin aşırı uyarım ve ekspresyonlarını önlerler. Böyle aktivite gösteren özel genlere tümör supresör genler (onkostatik genler, antionkogenler veya üreme supresör genleri) adları verilmektedir. Eğer bu genlerde mutasyonlar ortaya çıkarsa, bunların inaktivasyonuna veya normal fonksiyonlarının bozulmasına yol açarak kodladıkları regulatör proteinlerin de non fonksiyonel olmalarına neden olur ve kontrol mekanizması işleyemez hale gelir. Bu olgunun sonunda, protoonkogenlerin devamlı üreme proteinleri sentezleri nedeniyle hücreler sınırsız ve kontrolsüz ürerler ve tümör gelişimine sebep olurlar.
Tümör supresör genler tarafından spesifiye edilen tümör supresör proteinlerin (onkostatik proteinler) fonksiyonel olabilmeleri için, bunların da, hücre yüzeylerinde spesifik reseptörlere, sinyal transdüserlerine, nükleer transkripsiyon regulatör faktörlerine gereksinimleri bulunmaktadır.
Tümör supresör genlerin inaktivasyonları, dolaylı olarak, protoonkogenlerin kontrolsüz kalmalarına ve devamlı üreme proteini sentezlerine yol açarlar.
İnsanlarda saptanan başlıca onkostatik genler arasında, Rb (13q14), p53 (17 p13.1), APC (5q21), WT-1 (11p13) gibi genler bulunmaktadır. Bunlardan p53 geni üzerinde dermatoloji alanında fazlaca çalışmalar yapılmıştır. Hücre DNA'sının zedelenmesi sonucunda sentezlenen protein 53 (p53), zedelenme bölgesinde etkinlik göstererek hücre üremesini G1 fazında tutarak aşırı üremeyi kontrol eder ve DNA'daki bozukluk giderilince de bu protein ayrışarak etkinliği sona erer. Bu fonksiyon, gen de oluşan mutasyonlarla kaybolur ve sonunda hücre transformasyonları ve deri kanserleri meydana gelir.
Bazı araştırıcılar da, hücrelerdeki apoptozisi (hücrelerin fizyolojik ve programlı ölümleri) kontrol eden genlerin de tümörigenezisinde rolleri üzerinde durmaktadırlar. Böyle genlerde meydana gelen mutasyonlar, hücre ölümlerinin kontrol dışında kalmalarına ve ölümlerinin kontrolsüz hale gelmelerine yol açmaktadırlar.
03. Protoonkogenlerin Aktivasyonları (Viral Ve Nonviral Mekanizmalar)
Normal hücrelerdeki protoonkogenlerin aşrı aktivasyon ve aşırı ekspresyonu sonu sellüler onkogenler (c-onc) meydana gelirler ve bunlar onkoprotein sentezini spesifiye ederler. Uyarımlar her zaman, gerekli düzeyde olmayabilirler. Buna bağlı olarakta aşırı uyarım gelişemez ve tümör oluşumu da ortaya çıkmaz.
Protoonkogenlerin aşırı uyarımları bir kaç tarzda meydana gelebilir.
Yandaki şekilde İnsersiyonal mutagenezis gösterilmektedir. | 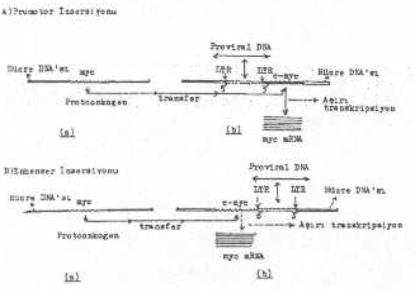
|
1) İnsersiyonal mutagenezis: Eğer, çok kuvvetli transkripsiyonal promotor/güçlendirici (enhenser) sekanslara sahip olan retroviral pro virus, hücre genomunda bulunan protoonkogenlerden birinin 5'-terminusuna çok yakın veya bitişik bir lokalizasyon gösterirse, bu zaman protoonkogenler, virusun kuvvetli sekanslarının (LTR, long terminal repeat) etkisi ve kontrolü altına girerek aşırı aktive ve eksprese olurlar. Bu şekilde onkogen haline dönüşen protoonkogenler, çok fazla üreme veya çoğalma proteinin sentezlerler. Bu substanslar da hücrelerin aşırı ve kontrolsüz üremelerine yol açar. Bu olgunun sonunda da tümörler gelişir. Örn, kanatlı genomunda bulunan c-myc geninin (sellüler protoonkogen) çok yakınına lokalize olan avian myeloblastosis virusu pro viral DNA'sı, sellüler genin 30-100 kat aşırı ekspresyonuna yol açtığı bildirilmiştir.
Yukarıdaki şekilde de görüldüğü gibi, pro viral DNA'nın promotoru, c-myc geninin 5'-ucuna bitişik olarak integre olursa ve bu geni transkripsiyon yönünde (RNA pol.un aktivitesi yönünde, 5'¾¾®3') kolayca ve çok sayıda myc mRNA'nın sentezine yol açar. Bu myc mRNA'lar, sitoplasmaya geçerek burada translasyona tabi tutularak çok sayıda onkoprotein (üreme proteini) sentezlenir (promotor insersiyonu).
Bazı durumlarda da, pro viral DNA, c-myc geninin 3'-terminusuna integre olabilir. Bu lokalizasyon, RNA pol'un transkripsiyonu yönünde değildir. Aynı zamanda pro viral DNA'nın promotorunun tam etkisi altında bulunmamaktadır. Ancak, bazı retroviruslarında, pro viral sekanslar, güçlendirici (enhenser) element olarak görev yaparak yukarı doğru (upstream, 5'¬¾¾3') etkileyerek c-myc protoonkogenini aktive edebilir ve transkripsiyonunu sağlayabilir (enhenser insersiyon).
Bazı durumlarda da, c-onc gen ürünlerinde meydana gelen kantitatif değişiklikler onkogenezis için yeterli bir neden olabilmektedir.
2) Kromozomal transpozisyon (translokasyon): Bir çok tümör hücresinin DNA'sında kromozomal anormallikler bulunmaktadır. Bu tür bozukluklardan birisi de translokasyondur. Bu olgunun esasını, protoonkogen taşıyan bir kromozom segmentinin bulunduğu yerden ayrılarak (veya çıkarak) çok kuvvetli bir promotor sekanslarına sahip olan başka bir genin önüne (5'-ucuna) veya arkasına (3'-terminusuna) integre olması, bu promotorun etkisi ve kontrolü altına girerek çok fazla uyarılması ve ekspresyona tabi olması, oluşturur. Eğer integrasyon, yeni lokalize olduğu genin 3'-ucuna olmuşsa, yer değiştiren gen çok fazla eksprese olabilir. Bunun en iyi örneği, Philadelphia chromosomudur (9:22). Bu olguda, 9. kromozomda bulunan c-abl protoonkogeni bulunduğu bu yerden ayrılarak, 22. kromozomda lokalizasyon gösteren ve çok kuvvetli promotor sekanslarına sahip olan bcr gen bölgesine integre olur ve promotorun kontrolü altına girerek aşırı ekspresyona tabi tutulur. Benzer tarzda, insanlarda B-lenfositlerin çabuk üreyen kanserlerinden olan Burkitt Lymphomadır. Bunda da, 8. ile 14. kromozomlar arasında bazı sekansların yer değiştirmesi söz konusudur. Kromozom 8'de bulunan myc geni, buradan çıkarak 14. kromozomda yerleşik İg (immunglobulin)'nin ağır zincirini kodlayan genin yanına lokalize olur ve bunun promotoru etkisi altına girer ve aşırı uyarılarak fazlaca eksprese edilir.
Yandaki şekilde kromozomal translokasyon gösterilmektedir. | 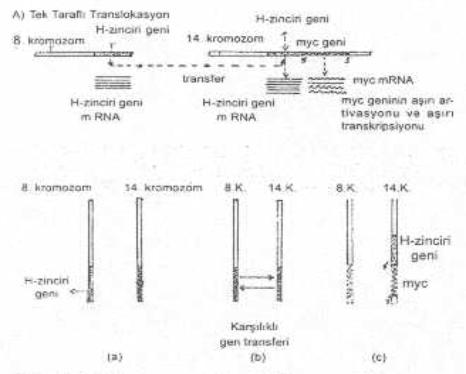
|
Kronik granulosistik leukemiaya yol açan Philadelphia chromosomu da, diğeri gibi, birer kromozomal translokasyon fenomenidirler.
3) Gen amplifikasyonu: Bazı tümör olgularında da gen amplifikasyonlarına rastlandığı açıklanmıştır. Böyle durumlarda, hücre içindeki bir genin yüzlerce kopyası meydana gelebilmektedir. Örn, dihidrofolate redüktaz enzimi inhibitörü olan anti kanser ilaçlardan methotrexatın kullanılması gen sayısının fazlaca artmasına yol açar. Bu olgu sonunda dihydrofolate geni fazla çoğalır ve enzim aktivitesi de hücre içinde artar (400 kat). İnsanlarda göğüs kanserlerinde HER-2/neu onkogeninin aşırı amplifiye olmasının önemli rol oynadığı bildirilmiştir. Benzer tarzda da diğer genler (c-ras, c-myc, vs onkogenleri) amplifiye olabilmektedirler.
c-ras geninin amplifikasyonu yandaki şekilde gösterilmektedir. | 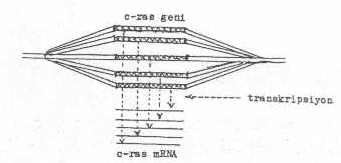
|
Gen amplifikasyonlarının, tümörlerin ilerlemelerinde ve daha fazla malignant (kötü huylu, habis) olmasında rollerinin fazla olduğu açıklanmaktadır.
4) Nokta (point) mutasyonu): Protoonkogenlerde meydana gelen nokta mutasyonları (bir bazın girmesi veya bir bazın çıkması sonu oluşan mutasyonlar) bu genlerin ürünleri olan proteinlerde de değişikliklerin (amino asit türü ve sırasında değişiklik) oluşmasına ve etkinliklerin farklı tarzda ortaya çıkmasına sebep olmaktadır. Normal insan hücrelerindeki c-ras protoonkogeninin DNA sekansları ile insan sidik kesesi kanser hücrelerinin c-ras onkogeninin DNA baz sırası analizleri karşılaştırıldıklarında aralarında bir bazlık farkın bulunduğu saptanmıştır (p 21'in 12. pozisyonunda değişiklik). Bu durum, hücrede GTPase aktivitesini azaltırken adenylate cyclase'ın da kronik stimulasyonuna neden olmaktadır. Böylece, hücrelerde metabolik aktivitede fazla artmalar ortaya çıkmaktadır.
İnsanlardaki tümörlerin bir çoğunda ras protoonkogenindeki nokta mutasyonlarından kaynaklanmaktadır. Örn, pankreas kanserlerinde yaklaşık %90 ve kolon ile tiroid kanserlerinde ise %50 ras protoonkogeni mutasyonlarından kaynaklandığı bildirilmektedir.
5) Retroviral (transdüksiyon) aktivasyon: Bir hücre retrovirus tarafından infekte edildiğinde, viral genom içine, sellüler DNA sekanslarından bir segment rekombinasyonla girebilir: Viral genomun bir parçası haline gelen sellüler sekans virusla birlikte replike olabilir ve böylece diğer hücrelere de yayılabilir. Bu tarz aktivasyon, protoonkogenlerin uyarılmalarında ve tümör oluşumunda etkin bir yol olarak düşünülmektedir. Virus tarafından alınan sellüler protoonkogenler çeşitli türden mutasyonlara (point mutasyon, delesyon, insersiyon, substisyon, vs) maruz kalarak kuvvetli promotor/enhenserlerin etkisi altına girerek onkogene haline dönüşebilmektedir.
04. Viral Onkogenler (v-onc)
Bazı tümör viruslarının (retroviruslar) genomlarında, sellüler protoonkogenlerin bir homologu veya analoğu olan genlere sahiptirler. Viral onkogenler (v-onc) olarak tanımlanan bu genler, hücrelerdeki protoonkogenlerin normal ekspresyonlarını değiştirebilecek yetenektedirler. Viral onkogenler, retroviruslarında, aslında, viral genomun orijinal veya virusun kendine ait yapısal bir segmenti olmayıp, sellüler kaynaklıdırlar. Viruslar bu onkogenleri, infekte ettikleri hücrelerin DNA'larından, pro viral DNA'nın transkripsiyonu sonunda alırlar ve başka hücreleri infekte ettiklerinde, hücrelere, taşıdıkları bu v-onc'ları, birlikte transfer ederler. Böyle viruslar (genomlarında v-onc geni taşıyanlar) in vitro, duyarlı hücre kültürlerinde morfolojik değişiklikler (transformasyonlar) meydana getirirler. Ayrıca, infekte ettikleri hücrelerin genomlarındaki sellüler protoonkogenlerin aşırı uyarılmalarını ve ekspresyonlarını sağlayarak tümör oluşumuna yol açarlar (retroviral transdüksiyon). Örn, insan sidik kesesi kanser onkogenlerinin Harvey sarkoma virusunun taşıdığı v-onc geni ile çok yakın bir ilişkisinin olduğu açıklanmıştır.
Şunu da belirmekte yarar vardır: bir virusun hücrelerde transformasyonlar meydana getirmesi, bu virusun her zaman kanser oluşturacağı anlamına gelmemelidir.
Bütün onkoviruslar (DNA ve RNA tümör virusları) aynı mekanizmaları kullanarak tümör oluşturmadıkları gibi, virus ve konakcı farkları da onkogenezis üzerine fazlaca etkilemektedir. Örn, Rous sarcoma virusu (RSV) kanatlılarda solid tümörlere ve diğer retroviruslar da, kanatlı ve memelilerde leukemia ve sarkomalara yol açarlar. Virusların, konakcı spektrumları yanı sıra oluşturuldukları tümör tipleri bakımından da aralarında farklar bulunmaktadır.
RNA tümör viruslarındaki v-onc'lar hücresel c-onc'ların bir analoğu olmasına karşın, DNA viruslarındaki v-onc'lar ise, virusun yapısal genleri arasında yer alırlar. Diğer bir ifade ile sellüler orijinli değildirler.
Retrovirusların genomunda bulunan v-onc'lar, RNA halinde olmalarına karşın, DNA viruslarında ise v.onc'lar DNA sekanslarıdırlar.
RNA viruslarında, virus hücrelere girince serbest kalan genom (RNA), çift iplikcikli pro viral DNA'ya (dsDNA) dönüştürüldükten sonra hücre çekirdeğine girerek nukleusa integre olur. Burada, hücresel RNA pol. enzimi tarafından transkripsiyona tabi tutulur. Oluşan genomik mRNA buradan tekrar sitoplasmaya geçerek transle edilir. Transkriptlerden iki molekül, sitoplasmada sentezlenen zarf içine paketlenir ve virus tomurcuklanarak dışarı çıkar. Böyle olgunlaşan virusun yapısında viral genom bulunduğu gibi, hücre kromozomundan aldığı bir protoonkogen de bulunabilir.
05. Multistep Onkogenezis
Çabuk transformasyon yapan bazı retrovirusları (Örn, Rous sarcoma virus, RSV) hariç tutulursa, diğerleri, yani yavaş transformasyon oluşturanlar da tümör formasyonu, hücre içinde gelişen tek bir olgu sonucu oluşmamaktadır. Ardışık gelişen, birbirlerinin etkilerin tamamlayan, aktive eden ve biri diğerine basamak oluşturan değişik faktör ve reaksiyonların bir zaman süreci içinde hücrelerdeki protoonkogenlerin aşırı aktivasyon ve ekspresyonlarına (transkripsiyonal aktivasyon) yol açarak bunların sellüler onkogenler (c-onc) haline gelmelerine ve onkoprotein sentezlerine neden olurlar.
Retrovirusların bazıları (Örn, Rous sarcoma virusu, RSV) bir onkogen (src) taşımalarına karşın Avian erythroblastosis virusu (AEV) iki v-onc geni taşıyabilmektedir.
Normal rat hücreleri (fibroblast), mutant c-ras ve polyoma virusu büyüt T geni ile, veya c-ras ve onkojenik adenovirus EIA erken geni ile veya v-ras ve v-myc genleri ile, birlikte kointransfekte edilirse, fibroblast hücreleri tümör hücreleri haline dönüşebilir. Böyle durumlar, tümörigenezisde birden fazla sellüler onkogenin bir arada ve ardışık rol aldığını ortaya koymaktadır. Bazı viral genler de (myc, Py-T geni) hücreleri immortalize ederek kültürlerde devamlı üreyen hücreler haline gelmesine yol açarlar.
Protoonkogenleri, viruslar dışında, fiziksel ve kimyasal karsinojenler de aktive edebilir ve tümör oluşumuna sebep olabilirler. Kimyasal karsinojenlerin organik veya inorganik yapıda olanları, bunların karsinojeniteye neden olan tek bir ortak yapı özelliği taşımadıklarını ortaya koymaktadır. Bazıları, direkt karsinojeniteye sahip olmalarına karşın, bir kısmı da onkojenik olabilmeleri için bazı ön metabolizma ve metabolitlere (prokarsinojenler) gereksinim duyarlar. Bu son durumda, prokarsinojenler, aktif karsinojenler haline dönüştürmek için, bir veya daha fazla enzimlerin katalize ettiği reaksiyonlara ihtiyaç duyulmaktadır (Aflatoksinlerde olduğu gibi). Bazen de, prokarsinojen olan bir maddeyi (Örn, 2-acetylamine fluorene, 2-AAF) karsinojenik (N-hydroxy-AAF'nin sülfat esteri) haline dönüştürmek için iki reaksiyon gerekmektedir. Bazı organlarda (deri ve karaciğer gibi) karsinogenezis iki aşamalı gerçekleşmektedir. Buna en iyi örnek farelerin derisi üzerinde yapılan bazı çalışmalar verilebilir. Eğer, farelerin derisine sadece, benzo (a) pyrene sürülürse hiç bir tümör gelişememektedir. Eğer, bu kimyasal maddeden sonra, croton yağı da bir çok defa sürülürse tümörler gelişebilir (gerek birinci ve gerekse ikinci kimyasal maddeler tek başlarına tümör oluşturmazlar). Burada, benzo (a) pyrene aplikasyonu bir başlangıç dönemini oluşturur ve buna başlatıcı ajan ismi de verilmektedir.
İn vivo gelişen tümörlerle in vitro üreyen, NIH 3T3 hücrelerinde, meydana gelen transformasyonlarda moleküler temel mekanizmalar hemen hemen birbirinin benzeridir. Multistep onkogenezise benzer bir örnek te şöyledir. Fare derisine önce polycylic hydrocarbon aplikasyonu yapılırsa, bu kimyasal madde deri hücrelerinde sellüler ras genini (c-ras) aktive eder. Bu bir ilk uyarımı (inisiasyon) oluşturur. Bu durum deride ve hücrelere de gözle fark edilemeyen bazı fenotipik değişikliklere yol açar. Aynı bölgeye, bir süre sonra, bir phorbol ester olan TPA sürülürse, bu defa, c-ras geninde mutasyonun meydana gelmesine ve bunun sonucunda da tümör gelişimine yol açar (gelişme ve ilerleme dönemleri). Bu kimyasal maddelerin hiç birisi tek başına deri hücrelerinde onkojenik transformasyonlara neden olmamaktadır.
Yukarıda açıklanan multistep onkogenezisin aksine, bazı DNA veya özellikle RNA viruslarında Rous sarkoma virusu (avian retrovirus) tek aşamada transformasyon yapabilecek bir güce sahiptir.
NIH 3T3 hücreleri üzerinde yapılan çalışmalarda, hiç bir ekzojenik ajan olmaksızın, uzun bir süre dilimi içinde spontan transformasyonların meydana geldiği gözlemlenmiştir. Ancak, böyle durumlarda, transforme hücrelerle, in vivo olarak farelerde başarılı sonuçlar elde edilememektedir. Bu durum, uzun süre içinde gelişen ve hücrelerde akümüle olan bir seri mutasyonlar sonunda ortaya çıkabileceğine de işaret etmektedir.
06. Tümör Hücre Onkogenleri
Tümör hücresi DNA ekstraksiyonlarında onkogenlerin varlığı ortaya konulmuştur. Böyle onkogenler, gen transferleri veya DNA transfeksiyon yöntemleriyle kolayca kanıtlanabilirler. Normal kültüre edilmiş hücre DNA'sında da benzer teknikler kullanılarak protoonkogenler saptanabilir. DNA'da transformasyon yapan genleri belirlemede, önce hücrelerin DNA'ları ekstre edilerek saflaştırılır ve alıcı hücrelere (Örn, NIH/3T3 hücreleri) CaPO4 (endositozise yardımcı olması için) veya uygun diğer transfeksiyon teknikleri ile verilir. Bir iki hafta sonra mikroskop altında hücrelerde transformasyonların gelişimi incelenir. Karakteristik yuvarlaklaşmış hücrelerin veya hücre odaklarının varlığı gözlenir. Ekstraksiyon, küçük ünitelere ayrılarak, deneme bir çok kez yinelendikten, böylece transformasyon oluşturan genlerin hangi ünitede olduğu saptandıktan sonra Southern blotting veya uygun bir işaretli problar kullanılarak genin lokalizasyon yeri belirlenir. Bu sellüler onkogenler, normal hücrelerin protoonkogenlerine çok benzerler. Ancak, aralarında azda olsa bazı yapısal farklar bulunmaktadır.
07. Hücre Transformasyonları
Viruslar, bakterilere oranla çok daha az ve sınırlı oranda genlere ve buna bağlı olarak ta genetik bilgilere sahip olmalarına karşın, duyarlı konakçıya veya konakcı hücrelerine girdiklerinde, hücrelerin üreme karakterlerinde bazı değişiklikler ve/veya dejenerasyonlar yapmaktadırlar. Hücrelerin üreme tarzlarında meydana gelen böyle değişikliklere, genel anlamda, transformasyon adı verilmektedir. Transformasyonlar, virusların türüne, konakcı hücresinin tipine (epitel, fibroblast, primer, sekonder, devamlı hücre, cell line) ve orijinine (insan, memeli, kanatlı, vs) göre değişebileceği gibi farklı tarzda transformasyonlar meydana gelebilmektedir. Viruslar hücre içine girdiklerinde, hücreye ait bazı özel genlerin ekspresyonlarını değiştirirler ve böylece, hücreler normal üreme, gelişme ve kontrol mekanizmalarını kaybederler. Ayrıca, viruslar, duyarlı konakcı hücresinin bütün replikasyon ve ekspresyon mekanizmalarını, diğer organelleri ve moleküllerini de ele geçirerek kendi replikasyon ve ekspresyonları için kullanırlar. Böyle durumlar da, hücrelerde bazı bozukluklara, morfolojik değişikliklere ve transformasyonlara yol açmaktadır. Genomlarında v-onc genleri taşıyan viruslar (özellikle, retroviruslar) böyle genlere sahip olmayanlardan daha fazla ve daha çabuk transformasyonlar yapabilmektedirler.
DNA viruslarının oluşturdukları transforme hücrelerde, genellikle, infeksiyöz virus partiküllerine veya viral sentezine rastlanamamasına (nonprodüktif) karşın, RNA virusları (özellikle, retroviruslar) prodüktif olabilmektedirler.
Transforme hücreler, bazı özellikle ile normal hücrelerden farklılıklar göstermekte ve bir kısım transformasyonlar da kalıcı bir nitelik kazanmaktadır. Böyle değişikliklerin bazı özellikleri aşağıda gösterilmiştir.
1) Hücre üreme tarzlarında değişiklikler: Hücrelerde yoğun ve kontrolsüz bir üreme, serum büyüme faktörlerine gereksinimde azalma, substratlara yapışma özelliğinde zayıflama, semi solid ortamlarda artan bir üreme kabiliyeti, kontakt inhibisyonun kaybolması, kültürlerinin devamlı ve kolaylıkla yapılabilmesi, immortalizasyon, suspansiyon kültürleri halinde üreyebilme, klon oluşturma yeteneğinde artma, hücre morfolojisinde değişikler, hücre refraktilitesinde artmalar,
2) Hücre yüzeyinde değişiklikler: Nütrientlerin hücre içine girme oranında artmalar, protease ve protease aktivatörlerinin sekresyonunda, bitkisel lektinlerle aglütinasyon kabiliyetinde artma, glikoprotein ve glikolipidlerin yapılarında değişmeler, virusun kodladığı proteinleri ve antijenik moleküllerin ortaya çıkması, fötal antijen ekspresyonu,
3) Biyokimyasal değişiklikler: Metabolizmada ve glikolizisde artmalar, siklik nukleotidlerin düzeyinde değişme, bazı sellüler genlerde aktivasyon veya supresyon, hücrelerde viral DNA, mRNA ve virusça kodlanan proteinlerin (antijenler) ortaya çıkması, sitoskeletonda bozukluklar, hücre şekillerinde değişiklikler, yapıştıkları yerlerden düşmeler, değişik boyanma özelliği,
4) Tümörigenesite: Transforme hücreler duyarlı deneme hayvanlarına şırınga edildiğinde tümör gelişebilir. Eğer, hayvanlarda immun yetmezlik hastalığı varsa, veya hayvanlara immunsupresif ilaçlar veriliyorsa veya irradyasyona maruz bırakılmışsa, tümör oluşumu daha kolay sağlanabilir.
5) Kromozomal değişiklikler: Virusla infekte veya transforme hücrelerin çekirdeklerinde kromozomal anormallikler gözlenebilir.
Fare fibroblastik hücreleri (NIH3T3, aneuploid hücreler), transformasyonlar, onkogenler ve diğer ajanların denenmesi için çok kullanılmaktadırlar. Bu hücreler, aynı zamanda, transfeksiyon çalışmalarda da çok yararlı olmaktadırlar. Çünkü, yabancı DNA segmentlerini almada çok uygundurlar. Ancak, bu hücreler, bütün transforman genleri saptayamazlar.Ayrıca, bütün tümör hücre DNA'ları da transformasyon yapmayabilirler (%50'ye yakın bir pozitiflik saptanabilir).
Hücre transformasyon çalışmalarında, aşağıda bahsedilen denemelerden fazlaca yararlanılmaktadır.
1) Fokus formasyon deneyi: Bu inceleme, duyarlı olan NIH 3T3 hücreleri üzerinde, yapılmaktadır. Hücrelerde refraktilite artar ve odaklaşmalar gözlenir.
2) Agara bağımsızlık deneyi: Primer hücreler ve bazı cell-line'ler, katı yüzeylere (cam, agar, vs) tutunarak ürerler. Sıvı ortam içinde veya jel gibi ortamlarda suspansiyon yapıldığında gelişemez ve üreyemezler. Halbuki BHK 21 hücreleri suspansiyon halinde kolaylıkla üreyebilmektedirler.
3) Serum gereksinimde azalma deneyi: Transforme hücreler, normallerinden çok daha az serumlu (%1-0.5) ortamlarda kolaylıkla çoğalabilirler.
Transformasyonların oluşmasında, viral onkogen ürünlerinin, normal sellüler gen ekspresyonunu ve sinyal transdüksiyon yollarını bozmasının da büyük rolleri bulunmaktadır. Viral onkogenler, bu olgulara olumsuz yönde etkiler ve normal sinyal akışını bozar.Onkogen ürünlerin kontrolsüz çoğalmaları ve yapılarının da biraz farklı olması, hücre bölünmesini hızlandıran değişik transkripsiyonal profiline yol açarlar.
Transforme veya malignant hücrelerin, normal hücrelerden ayrı olarak, yüzeylerinde antijenik moleküller oluşur ki bunlara tümör assosiye antijenler, (TAA) adı verilmektedir. Ancak, bazı TAA'lar hücre yüzeyinde değil plasma membranında lokalize olurlar (tümör spesifik transplantasyon antijenleri TSTA). Bu son antijen grubu transplantasyonda dokuların reddine neden olmaktadırlar.
RNA viruslarında infeksiyon, virus yüzeyindeki (özellikte, zarfta) bulunan protein ve/veya glikoproteinlerle, hücre yüzeyindeki spesifik reseptörler arasındaki ilişki sonucunda başlar. Bazı viruslarda bu afinite çok fazla olabilir ve hücreler infeksiyona duyarlı olurlar (permisif hücreler) veya bu ilişki çok zayıf olabilir veya hiç olmayabilir, bu zaman hücrelerde infeksiyon meydana gelmez (nonpermisif hücreler). Bazı viruslar da, sadece kendi konakcı hücrelerinde ürerler (ektotropik viruslar), bir kısım viruslar ise amfotropik bir özellik taşıyarak hem kendi konakcı hücrelerinde ve hem de yabancı hücrelerde üreyebilirler. Ksenotropik viruslar ise, doğal konakcı hücrelerinde değil, bazı yabancı, heterolog konakcı hücrelerinde çoğalırlar.
Permisif hücreler viral üremeyi kolaylaştırır ve viruslar fazlaca üreyerek çok sayıda yeni nesiller (projeni) oluştururlar. DNA virusları, genellikle, permisif hücrelerde lizis oluşturur ve fakat transformasyonlar yapmayabilirler. Nonpermisif hücrelerde viruslar üreyemezler. Bir virus için permisif olan hücre, diğeri için nonpermisif bir özellik taşıyabilir. Bazı virusların hücre tropizmi oldukça değişik ve spektrumları da oldukça dar olmaktadır. Örn, SV40 virusu Rhesus maymun böbrek hücrelerinde ürer, fakat transformasyon yapmaz. Buna karşın, rodent hücrelerinde üremelerine karşın transformasyonlar yapabilir. RNA virusları ise, ancak kendi doğal konakcı hücrelerinde transformasyon yapabilir. Çünkü, sitolitik değildirler. Bazı viruslar da heterolog hücreleri transforme edebilirler.
08. Tümör Virusları (Onkoviruslar)
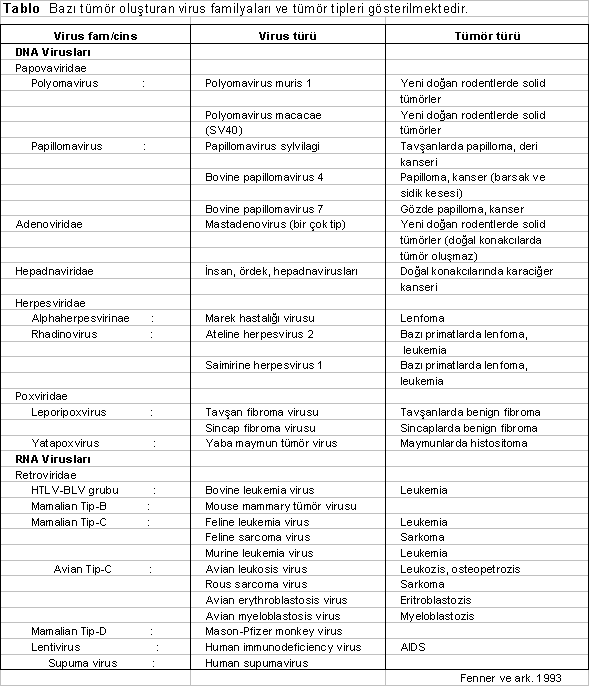 İnsanlarda ve hayvanlarda tümör oluşturan bir çok nedenin arasında biyolojik faktörlerden olan viruslar da (onkojenik viruslar, onkoviruslar) bulunmaktadır. Virusların onkojenik mekanizmaları bazı farklarla birbirlerine benzerlik göstermektedirler. Tümör oluşturan virusların başlıcaları aşağıda gösterilmiştir.
İnsanlarda ve hayvanlarda tümör oluşturan bir çok nedenin arasında biyolojik faktörlerden olan viruslar da (onkojenik viruslar, onkoviruslar) bulunmaktadır. Virusların onkojenik mekanizmaları bazı farklarla birbirlerine benzerlik göstermektedirler. Tümör oluşturan virusların başlıcaları aşağıda gösterilmiştir.
1) RNA virusları: Retrovirusları (+, 2, ssRNA)
2) DNA virusları: Adenoviruslar, herpesviruslar, hepadnaviruslar, papovaviruslar, poxviruslar
08.01. RNA Tümör Virusları (Onkornaviruslar)
RNA karakterinde genoma sahip ve tümör oluşturan viruslar arasında Retroviridae familyası (+,2, ss RNA) türleri bulunmaktadır. Bu familya içinde başlıca 3 cins yer almaktadır. 1) Oncornaviruslar (onkoviruslar): B,C,D, grupları, 2) Lenti viruslar: insan immun yetmezlik hastalığı (AİDS) virusu (HIV) ve Meadi/visna benzeri viruslar ve 3) Spumaviruslar.
Retroviridae Familyası
Retroviruslar, pozitif polariteli, identik 2 molekül tek iplikçik genoma sahiptirler (diploid genom). Virion, zarflı, sferik, 80-120 nm çapında, viral genomda, virusun hücrelerde replikasyonuna yardımcı olan revers transkriptaz enziminin kodlarını taşır (monomer genom 7000-11000 nukleotid, MA: 2-4 x 106). Virusun yapısında, %60 protein + %35 lipid +%3 karbonhidrat + %2 nukleik asit bulunur. Virus ikosahedral simetri gösterir. Monomer genomlar hidrojen bağı ile birleşmişlerdir. Bütün tümör oluşturan RNA virusları Retroviridae familyasında bulunurlar.
Retrovirusların yapısında başlıca üç grup antijenik substans vardır. Bunlardan biri, protein, glikoprotein ve lipid yapılarında olup zarfta lokalize olmuştur ve virusun genomundaki env (envelope) geni tarafından kodlanır ve tip spesifik bir karakter taşır. Diğeri ise grup spesifik antijenler olup virusun merkezinde lokalize olmuşlardır ve viral genomdaki gag (grup spesifik antijen) geni tarafından kodlanır. Üçüncü grup gen ise, revers transkriptaz enzimini kodlayan, pol (polimeraz) genidir. Viral genomun her iki ucunda promotor/güçlendirici (enhenser) aktivitesine sahip LTR (Long terminal repeat) sekansları yer almıştır. LTR sekansları uzunluk yönünden virus türlerine göre değişebilmektedir. Örn, Avian leukosis virusunda (ALV) 350 nukleotid bulunurken Moloney murine sarcoma virusunda (MMSV) 585 baz vardır. Retroviruslarda, genomun 5'-terminali kep'li (cap) olmasına karşın 3'-ucu ise poli A'lıdır.
Çok çabuk onkojenik aktiviteye sahip olan retroviruslarında bulunan temel 3 genin (gag, pol, env) dışında, bir gen daha (4.gen) bulunur ki oda, virusun yapısal genlerinden olmayan hücresel orijinli, v-onc (viral onkogen) genidir. Örn, RSV'unda bu 4. gen, v-scr (sarkoma) genidir. Sellüler orijinli olan bu geni, RSV, hücreleri infekte ettikten sonra kazanır. Bazı retroviruslarda yapısal gen ve v-onc gen lokalizasyonları ve viral genomun yapısı gösterilmiştir.
Bazı retroviruslarda onkogen lokalizasyonları yandaki şekilde gösterilmektedir. | 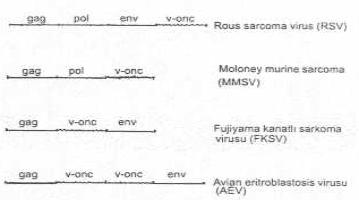
|
RSV’nin genomik yapısı yandaki şekilde gösterilmektedir. | 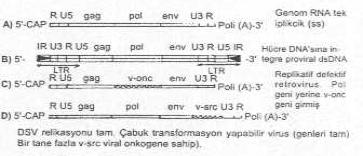
|
İnsan retrovirusunun genomik yapısı yandaki şekilde gösterilmektedir. | 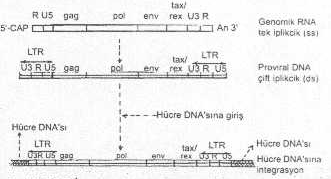
|
Retrovirusların en önemli özelliklerinden birisi ise, bunlar hücreleri infekte ettikleri zaman, genomlarında taşıdıkları revers transkriptaz enzimi yardımı ile pro viral DNA (pro virus DNA, çift iplikcikli) haline çevrilmesi ve bunun da hücre çekirdeğine girerek, kromozoma integre olmasıdır. Böyle durumda, viral DNA, hücre kromozomun bir parçası (segmenti) haline gelir ve birlikte eşzamanlı olarak transkripte olurlar. Eşey hücre (germ line) içine girebilen virus böylece nesillere aktarılabilir (vertikal transfer). Hücre kromozomuna integre olan virus, eğer hücrenin regulatör genlerinin kontrolü altına girerse, hiç bir zararlı etki yapmadan normal hayvanlarda, hücre içinde kalabilir. Böyle retroviruslara endojenik retroviruslar adı verilir. Eğer, böyle bir virus taşıyanlar (veya hücreler) çeşitli mutajenik ve karsinojenik faktörlere (irradyasyon, mutajenik veya karsinojenik kimyasallar, hormonal veya immunolojik uyarımlar, vs) maruz kalırsa, virus aktive olur ve üremeye başlar. Bunların aksine, bazı retroviruslarda infeksiyöz bir karakter taşır ve horizontal bir yayılma gösterirler. Böyle özellik gösteren viruslar ekzojenik retroviruslar olarak tanımlanmaktadırlar. Bu tür viruslar, çeşitli çevresel koşullara maruz kalarak meydana gelen mutasyonlar veya rekombinasyonlar sonunda da oluşabilmektedir. Ekzojenik retrovirusların gen sekansları sadece infekte hücrelerde bulunmasına karşın, endojenik retroviruslarınki ise bütün hücrelerin kromozomları içine lokalize olmuşlardır. Buna karşın, ekzojenik olan retrovirusların ekserisi onkojeniktir ve bazıları karakteristik olarak lenfoma veya leukemia meydana getirdiği gibi diğerleri de karsinomaya yol açabilirler. Ekzojenik retrovirusların bazıları çabuk onkojenik bir özellik taşımalarına karşın bir kısmı ise hücrelerde çok yavaş onkojenik etkinlik gösterirler. Kanatlıların Rous sarcoma virusu (RSV), duyarlı hayvanlarda, infeksiyondan 2 hafta sonra ölümlere yol açabilecek onkojeniteye sahiptir. Bu özelliği, viral genomda v-onc geninin bulunması, yaratır. Şimdiye kadar 60'dan fazla v-onc geninin varlığı bildirilmiştir.
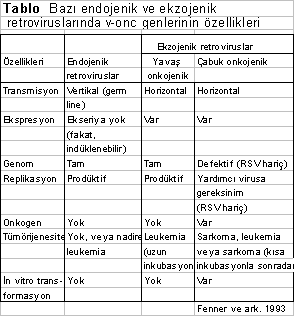
Ekzojenik retrovirusların ekserisi, genomlarında bir tek tip v-onc geni taşımaktadır. Örn, RSV genomunda v-scr onkogeni vardır. Yavaş (zayıf) onkojenik retroviruslarının genomlarında v-onc geni bulunmaz. Uzun bir inkubasyon periodundan sonra hücrelerde transformasyonlar yapabilirler. Nadiren de B-hücre, T-hücre veya miyeloid hücre leukemialarına da yol açabilirler. Örn, Avian leukosis virusu (ALV), bazı kanatlı ırklarında, hayat boyu viremi meydana getirir ve hastalık oluşturmaz.
08.02. DNA Tümör Virusları Ve Onkogenezis
DNA virus familyalarından bazıları da, duyarlı konakcı ve permisif hücrelerde, bazı RNA virusları gibi (retroviruslar), transformasyonlara ve tümör oluşumlarına yol açmaktadırlar. Spontan oluşan veya deneysel oluşturulan tümörlerin hücrelerinden DNA virusları izole edilmiş ve aynı zamanda, elektron mikroskopik muayenelerde de virus partiküllerine rastlanılmıştır.
DNA tümör virusları ile RNA tümör viruslarının taşıdıkları onkogenler arasında bazı farklar bulunmaktadır. DNA tümör viruslarında transforman proteinleri kodlayan genler (onkogenler), virusun yapısını oluşturan genler arasında yer alır ve viral replikasyonda da önemli fonksiyonları bulunmaktadır. Bu onkogenlerin, normal hücrelerde sellüler homologları (c-onc) yoktur. Halbuki, RNA tümör virusları (retroviruslar), kendi genomlarında, replikasyonları ile ilişkisi olmayan ve virusa ait olmayan, sellüler orijinli onkogenlere sahiptirler.
DNA viruslarında tümör oluşumundan sorumlu olan genlerin (onkogenler) kodladığı faktörler, viral DNA replikasyonunu (özellikle, erken gen proteinlerini) aktive ederler. Ancak, sadece bir virus geni de, tek başına, permisif hücrelerde transformasyon yapmada veya duyarlı konakçılarda tümör oluşumunu başlatmada yeterli bir güce sahip olduğu da düşünülmemektedir. Malignant transformasyonlar için, diğer sellüler faktörler veya onkogen ürünleri ile işbirliği içinde yürütülen multistep proseslere gereksinim vardır.
DNA tümör viruslarınca kodlanan bazı transforman proteinlerin normal hücre proteinleri ile kompleksler oluşturarak, bunların fonksiyonlarını bozduklarını ve iş göremez hale getirdiklerini ileri süren araştırıcılar bulunmaktadır. Böyle viral transforman bazı proteinlerin, hücrelerde interaksiyona girdiği hedef proteinler arasında tümör supresör gen ürünleri de bulunmakta ve bu gen proteinlerin regulatör ve kontrol görevleri inhibe edilmektedir. Tömorigenezisde bu olgunun önemi çok fazladır.
DNA viruslarının genomlarında bulunan spesifik genler, aynen retroviruslarında olduğu gibi, onkojenik bir aktiviteye sahiptirler ve malignant neoplastik transformasyonlara yol açabilirler. Nukleusa integre olan viral DNA, hücrelerde genlerin ekspresyonlarını ve hücrelerin normal büyüme düzenlerini bozarlar. Viral DNA'da bulunan erken gen ürünü proteinlerin bu tarzdaki etkinlikte dual fonksiyonu (hem viral replikasyonda ve hem de hücre transformasyonlarında) önemlidir.
Yukarıdaki tabloda da açıkça görüldüğü üzere, DNA virus onkogenlerinin protein ürünleri hücrelerde multifonksiyona sahip olup bu etkinlikler, proteinin özel bölgeleri tarafından yöneltilir ve oluşan onkoproteinler, normal sellüler proteinlerin fonksiyonlarına benzer aktivite gösterirler. Bu proteinler (onkoprotein), plasma membranında, sitoplasmada ve nukleusta lokalize olan hücre proteinleri ile kompleksler oluştururlar. Örn., polyomavirus orta T-antijeni (Py-MT), c-src proteini ile interaksiyona girerek, bu proteinin protein kinase aktivitesini artırır.
DNA tümör virusları hücrelerde başlıca iki karakterde infeksiyon oluştururlar.
1) Prodüktif (litik) infeksiyon: Bu tür infeksiyonda, virus, hücrelerde replikasyonunu tamamlar ve hücrelerde transformasyonlar meydana getirir. Hücreler parçalanarak virus dışarı çıkar (litik infeksiyon).
2) Nonprodüktif infeksiyon: Bu tarzdaki infeksiyonlarda, virus hücre içindeki replikasyonunu tamamlayamaz. Virusun bir kısmı veya tümü hücre çekirdeği içine girer (integre olur). Burada viral erken gen sekansları eksprese olur. Bu şekilde, latent infeksiyonlar meydana gelir.
DNA karakterinde genoma sahip olan viruslar arasında 5 familyaya ait türler hücrelerde transformasyonlar veya duyarlı konakçılarda onkojenik proseslere neden olmaktadırlar. Bunlara ait bilgiler aşağıda özet olarak verilmektedir.
1) Papovaviridae
2) Adenoviridae
3) Herpesviridae
4) Hepadnaviridae
5) Poxviridae
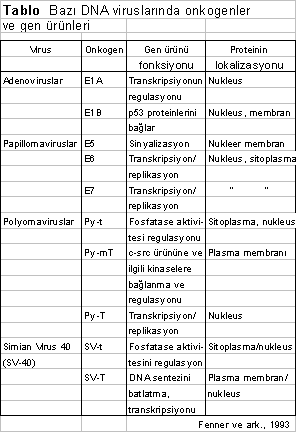
Papovaviridae Familyası
Bu familya içinde bulunan türlerin onkojeniteleri oldukça iyi incelenmiştir. Papovavirusları, küçük viruslar (45-55 nm çapında) arasında yer alırlar. Çift iplikcikli ve sirküler bir genoma sahiptirler (MA: 3-5 x 106 ve 5-6 kbp). Virion ikosahedral simetrili ve zarfsız olup DNA molekülü sellüler histona sarılarak virionun orta kısmında kondanse olmuştur.
Bu familyada 3 cins bulunmaktadır (papillomavirusları, polyomaviruslar ve Vakuol oluşturan viruslar). Bu cinslere ait virusların genom karakterleri ve organizasyonları arasında bazı farklar bulunmaktadır.
1) Polyomaviruslar: Bu gruba ait viruslardan olan Simian virus 40 (SV 40) en fazla incelenen türü oluşturmaktadır. DNA'larında sınırlı sayıda (6-7) gen bulunur. Zarfsız, ikosahedral simetrili, çift iplikcikli, sirküler bir genoma sahiptirler (3x106 ve 5 kbp). Virus konakcı kromozomunun çeşitli yerlerine integre olabilir ve onun bir devamı haline gelebilir. Eğer konak hücreler irradyasyona tabi tutulursa veya mutajenik kimyasal maddelerle muamele edilirse, virus aktive olabilir ve üreyebilir.
Viral genomun hücre kromozomuna integrasyonu, her zaman ve her virus için transformasyonla sonuçlanmayabilir. Ayrıca, bazı transforme hücrelerde, sonradan, pasajlarla, normal orijinal formlarını tekrar kazanabildikleri gibi her transforme hücre duyarlı konakcıda onkojenik bir özellik göstermeyebilir. Denemelerde kullanılacak duyarlı hayvanların çok iyi seçilmesinde yararlar vardır. Bu amaç için en fazla atimik fareler, singenik fareler veya NIH 3T3 hücreleri denenebilir.
Genellikle, papovaviruslarının genomlarında iki önemli gen bölgesi bulunmaktadır. Bunlardan biri erken proteinleri kodlayan erken gen bölgesi ve diğeri de geç gen bölgesidir. Erken gen bölgesinde bulunan genler, virus hücre sitoplasmasına ulaşınca ilk defa eksprese edilen genleri kapsamaktadır. Sentezlenen erken proteinler, virusların permisif hücrelerde replikasyonlarında fonksiyoneldirler. Yaklaşık 3000 bp den oluşan polyomaviruslarında bu bölge, T-antijeni (tümör antijeni) bölgesi olarak tanımlanır. Polyomaviruslarında bu bölgede başlıca 3 erken protein sentezinin kodlarına sahiptir, (küçük, Py-t; orta, Py-mT ve büyük, Py-T antijenleri). Bunlardan biri veya ikisi, hücrelerde transformasyonlar oluşturmada etkindirler. Transforman proteinler (transformasyon oluşturan proteinler) sürekli sentezlenerek, hücrelerdeki transformasyonların devamını sağlarlar. Bu erken proteinler immun fluoresans yöntemi ile ortaya konabilirler.
Polyomaviruslarında, büyük T-antijenleri, transforme hücrelerin nukleuslarında ve orta T-antijenleri de hücre membranlarında bulunan c-src proteinleri ile birleşerek tyrosine-kinase aktivitesini artırırlar. SV 40 viruslarının ekserisinde büyük T-antijenleri nukleusda bulunmasına ve burada aktivite göstermesine karşın, az olarak ta plasma membranında lokalize olabilir ve tümör rejeksiyon reaksiyonlarında önemli olan sitotoksik T-hücreleri (CTL) için hedef bölgeyi oluştururlar. SV 40 virusunun büyük T-antijenleri tümör supresör gen ürünü proteinlerle de (p53, Rb) birleşerek kompleksler yapabilirler. Bu tür ilişkiler (T-antijenlerini ile sellüler proteinler arasındaki interaksiyonlar) hücrelerde transformasyonların meydana gelmesi için gereklidirler. Diğer bir ifade ile, T-antijenlerinin hücre transformasyonlarındaki etkinlikleri ve ilişkileri oldukça fazladır. Örn, Py-mT antijenleri, hücre morfolojilerinde değişikliklere yol açtığı gibi, böyle hücrelerin semi solid ortamlarda suspansiyonlar halinde üremelerine de neden olurlar. Büyük T-antijenleri (Py-T-antijeni) hücre üremelerinin seruma bağımlılığını azaltan etkiye de sahiptir.
SV40 virusunun temel yapısı yandaki şekilde gösterilmektedir. | 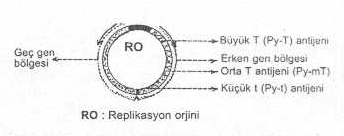
|
SV40 büyük T antijeninin bazı özellikleri
1) 100 kDa'luk bir fosfoprotein,
2) Genellikle, hücre nukleusunda bulunur,
3) Konakcı DNA sentezini uyarır,
4) Transformasyonların başlatılması ve devamı için gereklidir,
5) SV40 virusunun replikasyon orijinine bağlanır,
6) Helikaz ile birlikte, ATPase aktivitesine sahiptir,
7) Virus replikasyonunda etkilidir,
8) RNA sentezini uyarır,
9) p53 ve RB supresör gen ürünlerine bağlanır,
10) DNA polimeraza bağlanır
11) Sellüler heat shock proteinlerine (hsp 70) bağlanır.
Polyomavirusları, doğal konakçısı olan maymun hücrelerinde ve ayrıca genç fare hücrelerinde ürer. Bazı heterolog hücrelerde de (hamster) transformasyonlar yapabilir. Polyomavirusları, yeni doğan farelerde çeşitli tipte tümör formasyonlarına da yol açabilir.
Polyomaviruslarının geç gen bölgesi proteinleri ise, daha ziyade, viral genomun asamblesinde, özellikle, kapsid proteinlerinin (VP1, VP2, VP3) ve diğer aşamalarda fonksiyonel olan yapısal proteinlerin sentezinde kullanılırlar.
2) Papillomavirusları: Bu viruslar, polyomaviruslarından daha büyük (55 nm) olup molekül ağırlığı da daha fazladır (5 x 106). Viruslar, zarfsız, çift iplikcikli, ikosahedral simetrili ve sirküler DNA'ya sahiptirler (8 kbp).
Papillomaviruslarının epitel ve mukozal hücrelere karşı özel bir tropizmi bulunmaktadır. Virus, hücrelerde transformasyonlar, epidermiste, genital organlarda iyi huylu siğil benzeri (papilloma) oluşumlara yol açarlar. Ayrıca, viruslar, larengial papillomalardan ve servikal kanserlerden de sorumlu tutulmaktadırlar. Sığır ve tavşanlarda da benzer yapılar görülebilir.
Viral genom, nadiren hücre DNA'sına integre olur. Genellikle, sitoplasma içinde sirküler DNA halinde bulunur. Bu durum, virusların tümör oluşturmaları için, konakcı hücre DNA'sına integre olması gerekmeyeceğini de ifade etmektedir.
Herpesviridae Familyası
Herpesviruslar, büyük viruslar (100-200 nm çapında) arasında yer alırlar. Çift iplikcikli ikosahedral simetrili, lineer, zarflı bir genoma sahip olan herpesvirusları hücrelerin çekirdeklerinde replike olurlar. DNA'nın molekül ağırlığı 100 x 106 kadar ve 120-220 kbp).
Herpesvirus tip-1 ve -2 ile Cytomegalovirus (CMV) hücrelerde az oranda transformasyonlara neden olurlar. Alpha herpesviruslarından Marek hastalığı virusu, tavuklarda lenfoproliferatif infeksiyonlara (Marek hastalığı) yol açar. Gamma herpes viruslarından olan Epstein Barr virusu (EBV) insanlarda Infectious mononucleosis (Burkitt lymphoma) etkenidir. Özellikle, bu hastalık immunsupresif çocuklarda fazla görülür. Beta herpesviruslarından Cytomegaloviruslar (CMV), insanlarda, özellikle küçük çocuklarda, sitomegalik hücre bozuklukları meydana getirir.
Hepadnaviridae Familyası
Bu familya, insan ve hayvanlarda hepatosellüler karsinoma oluşturan virus türlerine sahiptir. Ancak, hepadnaviruslar, genellikle, tek olarak değil, multifaktörial onkogenezis özelliğine sahiptirler. Örn, Pekin ördeklerinde rastlanan tümörlerin, aflatoksikozis sonu meydana çıkabildikleri gösterilmiştir. Bu viruslarda bulunan özel proteinin (HBx), konakcı hücrelerinin büyüme (çoğalma) genlerini (c-myc ve c-fos gibi) aktive ettiği ve ayrıca hücresel tümör supresör gen ürünü proteinleri suprese ettikleri belirtilmiştir. Karsinoma hücrelerinde viral genomun, hücre kromozomunun 6-7 yerine integre olduğu açıklanmıştır.
Hepatosellüler onkogenezisde, gen rearrajmanlarının, delesyonların kromozomal translokasyonların ve siroza bağlı kronik regenerasyonların rolleri olduğu belirtilmiştir.
İnsanlarda da hepatosellüler onkogenezise DNA viruslarından Hepatitis B virusu neden olmaktadır. Bu virus aynı zamanda, kronik karaciğer bozukluklarına da yol açar. Hepatitis B virusu taşıyıcılarından alınan tümör hücrelerinde, viral DNA'nın hücre kromozomuna integre olduğu gösterilmiştir. Ancak, virus genomunda onkogene rastlanamamıştır. Virus indirekt olarak (insersiyonal mutasyon veya transaktivasyon mekanizmalar ile) tümörigeneze yol açtığı belirtilmektedir. Hepadnaviruslar, hücre kültürlerinde transformasyonlar yapmamaktadırlar.
Poxviridae Familyası
Poxviridae familyası virusları, çift iplikcikli, lineer DNA'ya sahip briket veya tuğla biçiminde büyük viruslar arasında yer alırlar (MA: 130-240 x 106). Hücre sitoplasmasında replike olurlar. Viral genom, kendi replikasyonun da fonksiyonu olan, bir çok enzimim kodlarına sahiptir. Poxvirusları insan ve hayvanlarda hastalıklara yol açarlar.
Poxvirusları iyi huylu tümöral oluşumlara yol açabildiği belirtilmiş olup bunların malignant bir duruma geçtiği veya hücre DNA'sına integre oldukları gösterilememiştir. Çiçek viruslarının erken gen proteinlerinin epitelial hiperplasialarda etkinliği olduğu açıklanmıştır.
Yaba virusları doğal konakçısı olan maymunlarda benign tümörlere ve Shope fibroma virusu da tavşanlarda fibromalara yol açarlar. İn vitro olarak ta hücrelerde değişiklikler meydana getirebilirler.
Çiçek virusları ile infekte hücrelerde sentezlenen erken gen proteinlerinin epidermal büyüme faktörleri ile bir homologluğunun bulunduğu belirtilmiştir.
Epitelyal hiperplasia, poxviruslarınca oluşturulan karakteristik bozukluklar arasında yer alır.
Virus tarafından oluşturulan papillomalar, genellikle, zamanla kendiliğinden gerilemektedirler. Çok nadiren malignant hale dönüşebilirler. Bovine papilloma virusu (BPV, 7 tipi) tarafından, vücudun tüysüz ve pigmentsiz bölgelerinde, özellikle, gözde oluşan papillomalar, güneş ışınlarının aktivasyonu sonu kötü huylu tümörler haline geçebilirler.
Tavşanların shope papilloma virusu, insan siğil virusu için bir örnek oluşturmuştur. Tavşanlarda iyi huylu papillomalara neden olur ve virus, malignant tümörlerin hücre DNA'sına da integre olabilir.
Oluşan papilloma hücreleri içinde virus partiküllerine nadiren rastlanabilir. Karsinomalar içinde ise viral genom (sirküler DNA halinde) in situ hibridizasyon tekniği ile ortaya konulabilir.
Papillomaviruslar, rodentlerde fibromalara yol açabilirler. Viruslar, derinin bazal membranında bulunur. Buna karşın, virusun geç gen bölgesi genlerinin ekspresyonu, stratum corneumdaki keratinositlerde meydana gelir. Papillomaviruslarının konakçının keratinize hücre proteinlerinden yararlanmaları nedeniyle, polyomaviruslarından ayrılırlar.
Papillomaviruslarının erken gen bölgesi ürünlerinden olan E1-E6 ve E8 proteinleri replikasyon ve onkojenik transformasyonlar için ve geç gen bölgesi proteinleri de strüktürel proteinleri ve kapsid proteinleri için önemlidir. E6, p53 proteini ve E7 de retinoblastoma gen ürünü pRB ile birleşir. Erken gen ürünü proteinlerinden olan E5, papillomaya yol açan epitel hücre proliferasyonunu başlatmada etkindirler. E6 ve E7 gen ürünü proteinler hücre transformasyonlarında fonksiyoneldirler.
Adenoviridae Familyası
Adenoviruslar orta büyüklüktedirler (65-75 nm çapında, MA: 20-25x106) DNA, zarfsız, çift iplikcikli, lineer ve ikosahedral simetriye sahiptir. Virionun köşelerinde fiberler bulunur ve virus 252 kapsomerli bir kapside sahiptir. Virusların 41 kadar antijenik tipi bulunmaktadır.
Adenoviruslar, rodent hücrelerinde transformasyonlar yapar ve hücrelerin hem nukleus ve hem de sitoplasmasında lokalize olan erken gen ürünü proteinlerini sentezlerler. EIA olarak tanımlanan erken proteinler, sellüler büyüme faktörlerinin enhenser (güçlendirici) sekanslarını aktive ederler. E1A aynı zamanda, MHC I'in ekspresyonunu da önleyici etkiye sahiptir. Halbuki, nononkojenik adenoviruslar MHC I'in ekspresyonuna tesir etmezler. E1A, erken proteinleri sellüler Rb(retinoblastosis) proteinleri ile ve diğer sellüler proteinlerle de kompleksler oluşturur. Diğer erken proteinlerden olan E1B proteini de p53 proteinlerini bağlama yeteneğine sahiptirler. Böylece, tümör supresör genleri tarafından oluşturan Rb ve P53 proteinleri etkisiz hale gelmiş olurlar.
Farklı serotipler, yeni doğan hamsterlerde değişik derecede tümörlere yol açarlar. Ayrıca, hücrelerde transformasyonlar ve doğal konakcı hücrelerinde de litik infeksiyonlara neden olurlar.
İnsan, sığır ve kanatlılara ait bazı adenovirusları yeni doğan hamsterlerde tümörlerin gelişmesine sebep olurlar. Ancak, bu viruslar doğal konakçılarında tümör oluşturamazlar.
[1] Kaynak : Temel Mikrobiyoloji