Viral Aşılar
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji 1
01.Genel Bilgiler
02. Klasik (Konvansiyonel) Aşılar
02.01. Aktif (Canlı) Aşılar
02.02. İnaktif (Ölü) Aşılar
02.03. Aşılarda Aranacak Başlıca Hususlar
03. Biyoteknolojik Aşılar
03.01. İleri Teknoloji ile Hazırlanan Aşılar
03.02. Genetik Mühendisliği İle Hazırlanan Aşılar
04. Antiviral İlaçlar
04.01. Antiviral Kemoterapötikler
05. İnterferon (İfn)
01.Genel Bilgiler
Aşılar, insan ve hayvanlarda humoral ve sellüler karakterde oluşan aktif bağışıklığı uyararak infeksiyonlara karşı koruma sağlayan biyolojik maddelerdir. Ancak, vücudun mikroorganizmalara karşı korunmasında, pasif bağışıklığın da rolü fazladır ve her ikisi (aktif ve pasif bağışıklık) birden etkin olurlar. Sadece biri yeterli değildir.
Aktif bağışıklık için kullanılan aşılar başlıca iki gruba ayrılırlar.
1) Klasik (konvansiyonel) aşılar (aktif ve inaktif)
2) Biyoteknolojik aşılar
02. Klasik (Konvansiyonel) Aşılar
Canlıları viral infeksiyonlardan korumak amacıyla hazırlanan klasik aşılar bugün de etkinliğini sürdürmektedir. Bazıları çok iyi bağışıklık (aylar, hayat boyu) vermesine karşın, diğer bir bölümü ise kısa süreli bir immunite sağlamaktadır.
Pratikte kullanılan viral aşılar başlıca 2 tarzda hazırlanmaktadır.
02.01. Aktif (Canlı) Aşılar
Bu tür aşılar, virusların doğal veya suni tarzda attenüasyonları sonu elde edilen canlı viruslardan hazırlanırlar. Aşı materyalinde viruslar, bütün olarak (yapısal) ve istenilen konsantrasyonda bulunurlar. Doğal attenüe aşı suşları, suni olarak attenüe edilen suşlardan daha güvenli ve standarttırlar. Tekrar virulens kazanma olasılığı, doğal attenüe suşlarda, çok zayıftır.
Bu aşılar vücuda verildiklerinde, ürer, yayılır ve immun sistemi (lenfoid ve miyeloid hücreleri) uyarırlar. Bu uyarımın, derecesi, vücuda giren virusun, antijenik yapısına, virulensine, miktarına, giriş yoluna ve konakçının bağışıklık durumuna, yaşına, cinsine ve duyarlılığına göre değişebilir.
Suni attenüe canlı aşılar, virusların doku kültürü, embriyolu yumurta ve deneme hayvanlarında bir seri pasajları sonu meydana gelirler. Bu tür attenüasyonlarda çok dikkatli olmak ve attenüasyon durumunun iyi bir kontrolden geçirilmesi gereklidir. Geri mutasyonla tekrar virulens kazanma ve infeksiyon oluşturma olasılığı vardır.
Attenüe aşılar, immun yetmezliği olan şahıslarda, kronik, gizli ve latent infekte bireylerde, immun supresif ilaç kullanan şahıslarda, otoimmun hastalarda, kullanılırsa infeksiyon oluşturabilir.
Canlı aşıların bazı avantaj ve dezavantajları vardır. Bunlar da,
Avantajları: Daha iyi bir uyarım yaparlar, çeşitli yollardan (derialtı, peroral, kas içi, sprey, içme suyu, burun-göz damlası, vs.) vücuda verilebilirler, hazırlanmaları kolaydır, oluşan bağışıklık uzun süreli olabilir.
Dezavantajları: Kontamine olabilirler, tekrar virulens kazanabilirler, aşı kombinasyonları yoktur, etrafa bulaşabilir ve yayılabilirler, immun yetmezliği olanlarda ve immunsupresif ilaç alanlarda infeksiyon oluşturabilirler, virus konsantrasyonu gerekebilir, muhafazaları sorun yaratabilir.
Başlıca canlı aşılar
- Çiçek aşısı - Sığır vebası
- Polio aşısı (sabin) - At vebası
- Kabakulak - Newcastle
- Kızamık - Marek
- Kızamıkcık - Gumboro, vs.
- Sarı humma
02.02. İnaktif (Ölü) Aşılar
İnaktif aşılar virulensi yüksek suşların çeşitli yöntemlerle (fiziksel ve kimyasal) inaktive edilmesi sonu hazırlanırlar. İnaktivasyonda kullanılan inaktivanlar virusların antijenik yapılarına zarar vererek veya değiştirerek, vücutta oluşturduğu yanıtta farklılık meydana getirebilir ve virulent suşlara karşı koruma gücünde azalma yaratabilir. Buna dikkat etmek gerekir.
İnaktivasyon iyi yapılamadığı hallerde infeksiyonlara yol açabilir. Vücutta oluşturduğu uyarım genellikle zayıftır. Bunu gidermek için, aşıya çeşitli adjuvantlar karıştırılır ve birlikte vücuda (deri altı veya kas içi) verilirler. Virusun konsantrasyonu da gereklidir. İki veya üç kez kullanırlar.
İnaktif aşının da avantaj ve dezavantajları bulunmaktadır.
Avantajları: Kontaminasyonlardan etkilenmez, aşı kombinasyonları mümkündür, infeksiyon oluşturmaz, etrafa bulaşmaz ve yayılmaz, her canlıya istenilen miktarda aşı materyali verilebilir.
Dezavantajları: Bağışıklık kısa sürelidir, lokal reaksiyonlara yol açabilir, konsantrasyonu gereklidir, iyi bir inaktivasyon yapılmamışsa infeksiyonlara yol açabilir, büyük dozlar halinde kullanılır, tek tek uygulanır, adjuvantlara gereksinim vardır.
Başlıca inaktif aşılar
- Influenza A ve B - Şap aşısı
- Poliomiyelitis - Newcastle
- Kuduz - İnfeksiyöz bronchitis, vs.
- Hepatitis B
Şunu da belirtmek gerekir ki aynı aşının hem aktif hem de inaktif hazırlanmış formları bulunmaktadır.
02.03.Aşılarda Aranacak Başlıca Hususlar
1) Aşılar etkili olmalı, uzun süre bağışıklık vermeli,
2) Uzun süre dayanmalı, muhafaza edilebilmeli,
3- Tek bir dozun oluşturduğu bağışıklık yeterli olmalı,
4) Yan ve toksik etkileri olmamalı,
5) Ucuz olmalı, kolay bulunmalı,
6) Güvenilir olmalı,
7) İnfeksiyon oluşturmamalı.
03. Biyoteknolojik Aşılar
Klasik aşıların avantajları yanı sıra bazı dezavantajları da bulunmaktadır. Bunların bir kısmını gidermek için biyoteknolojik aşılardan yararlanılabilir. Ancak, bu son teknoloji aşılarının, hala pahalı olmaları, kolay bulunmamaları, hazırlanmalarının güç olması yanı sıra deneyimli personele ve gelişmiş laboratuvarlara gereksinimleri vardır. Eğer, klasik aşılar iyi ve yeterli bağışıklık veriyorsa, kolay ve ucuz hazırlanabiliyor ve bulunabiliyorsa, yan ve toksik etkileri önemsiz ise, hazırlarken insanlar için bir tehlike yaratmıyorsa, o zaman, klasik aşı üretimi tercih edilmelidir.
Biyoteknolojik yöntemle hazırlanan aşıların avantajları da fazladır. Şöyle ki, aşı içinde mikroorganizmanın genomunun sadece küçük bir sekansı bulunur, tümü değil. Bu nedenle infeksiyon oluşturmaz. Bu sekans vücutta sadece bağışıklığı uyaran proteini (antijeni kodlayan bir gen olduğundan, diğer yabancı ve zararlı proteinlerin sentezini spesifiye eden ve konakçıya zarar veren genleri taşımamaktadır. Muhafazası kolaydır ve uzun süre saklanabilir. Ancak, biyoteknolojik aşıların bir kısmı hapten karakteri taşıdığından uygun ve özel adjuvantlarla birlikte vücuda verilmesi gerekmektedir.
Bugün, insan hekimliğinde biyoteknolojik yöntemle hazırlanan ve kullanılan Hepatitis B aşısı oldukça başarılı sonuçlar vermektedir. Diğer önemli hastalıklar için de güvenilir ve etkili aşılar zamanla ortaya çıkacaktır.
Bazı moleküler teknikler kullanılarak hazırlanan aşıları başlıca iki kategoride incelemek mümkündür.
A) İleri Teknoloji ile Hazırlanan Aşılar
1) Sentetik peptid aşılar
2) Antiidiotip antikor aşıları
3) Subünit aşılar
B) Genetik Mühendisliği İle Hazırlanan Aşılar
1) Mutant aşılar
2) Subünit aşılar
3) Marker aşılar
4) Rekombinant mutant aşılar
5) Rekombinant ürünü aşılar
6) Nükleik asit aşıları (DNA aşıları)
Yukarıda sınıflandırılan aşıların çok kısa tanımlaması yapıldıktan sonra, son yıllarda önemi artan "Nükleik asit aşıları" hakkında gerekli bilgiler verilecektir.
03.01. İleri Teknoloji ile Hazırlanan Aşılar
1) Sentetik peptid aşılar: İnfeksiyon etkenlerinin (bakteri, virus, parazit) immunojenik olan komponentlerinin protein yapıları (aminoasit sayısı, türü ve sıraları) belirlendikten sonra, in vitro koşullarda yeterli miktarda kimyasal sentezleri yapılır ve elde edilen peptidler aşı olarak kullanılabilir. Bu peptidler (antijenler) vücuda şırınga edilerek koruyucu antikorların meydana gelmesi sağlanır. Virus, bakteri ve parazitlere karşı koruyucu amaçla sentetik peptidler hazırlanmış ve kullanılmıştır.
Bu aşılar vücutta infeksiyon oluşturmaz ve üremezler. Bu tekniğin kullanıldığı ajanlar arasında bakteriler (E. coli, V. cholerae, S. pyogenes, vs), toksinler (difteri toksini), viruslar (Hepatitis B, influenza, HIVS-1, Poliovirus, şap virusu, vs) ve parazitler (P. falciparum, vs) bulunmaktadır.
2) Antiidiotip antikor aşılar: Spesifik bir etkene (antijene) karşı bir deneme hayvanında hazırlanmış olan idiotip antikorların (Ab1) tekrar farklı bir deney hayvanına verilmesi halinde oluşan antiidiotip antikorlar (Ab2) aşılamada kullanılabilir ve protektif bağışıklık elde edilebilir. Bu ikinci antikorlar (Ab2), ilk verilen antijenin epitopu ile aynı internal imaja sahiptirler ve koruyucu antikorların sentezini uyarırlar.
Bu teknikle bakterilere (H. influenzae, N. meningitidis, S. pneumoniae, E. coli, L. monocytogenes, vs), viruslara ( WEE, poliotip-II, kuduz virusu, HSV, Reotip 3, vs) parazitlere (S. mansoni, T. rhodesiense, T. crusei, Eimeriae sp., vs) karşı antiidiotip antikor aşıları hazırlanmış ve kullanılmıştır.
Bu aşılar da infeksiyon oluşturmazlar ve vücutta üremezler.
3) Subünüt aşılar: Bu tür aşılar bir kaç değişik strateji kullanılarak hazırlanabilirler.
a) Mikroorganizmaların antijenik komponentlerinin (pilus, flagella, kapsül, protein, glikoprotein, toksin, peplomer, vs) çeşitli yöntemlerle izole edilip saflaştırıldıktan sonra bunların direkt olarak vücuda verilmesi sonunda bağışıklık sağlanabilir.
b) Mikroorganizmaların antijenik komponentleri (protein) saptandıktan sonra, bu proteinlerin aminoasit sayısı, türü ve sırası belirlenerek laboratuvarlarda özel tekniklerle sentezleri sonunda elde edilen peptidler aşı olarak kullanılabilirler. Bu teknikle bakteri, virus ve parazitlere karşı subunit aşılar hazırlanmıştır.
Bu aşılar da infeksiyon oluşturmaz ve vücutta çoğalmazlar.
03.02. Genetik Mühendisliği İle Hazırlanan Aşılar
Bu başlık altında, mikroorganizmaların genomlarında, yapılan çeşitli manipulasyonlar sonucunda elde edilen mutant ve rekombinant mutant mikroorganizmalar ile bunların ürünlerinin ve antijenik fraksiyonlarının aşı olarak kullanılması amaçlanmaktadır.
1) Mutant aşılar: Mikroorganizmaların genetik materyallerinde (genomlar) yapay olarak oluşturulan değişiklikler (mutasyonlar) sonucunda meydana gelen ve parental mikroorganizmalardan bir veya birkaç yönden farklı organizmalar (mutant) aşı olarak kullanılabilirler. Bu mutant suşların hastalık yapıcı veya virulens genleri çıkarıldığı için infeksiyon oluşturamazlar, ancak vücutta çoğalabilirler.
Bu tür aşılar arasında bakteriler (S. typhi Ty2la, V. cholareae, S. typhimurium aro ASL 3261 suşu, BCG, MaxSterne, v.s) ve viruslar (kuduz virusu, at vebası virusu, Newcastle virusu, I. bronchitis, v.s.) bulunmaktadır.
Ancak, böyle mutant suşların spontan geri mutasyonlarla tekrar patojenik formları kazanmaları olasıdır. Bu nedenle dikkatli bulunmakta yarar vardır.
2) Subünit aşılar: Subünit aşılar, bir veya birkaç saf veya yarı saf antijenik komponent içeren aşılar olarak kabul edilmektedirler. Bu aşılarda, mikroorganizmaların spesifik antijenik proteinlerini kodlayan genleri çıkarılarak, bunların plasmidle birleştirildikten sonra alıcı hücrede genin ekspresyonunun sağlanması ve elde edilen gen ürününün aşı olarak kullanılması esas amacı oluşturmaktadır.
Örneğin, pilus, kapsül, flagella, toksin genleri, peplomerler, yüzey antijenleri (HBsAg, v.s.), glikoproteinleri v.s kodlayan genler bu tarzda bir bakteri veya bir maya hücresine (S. cerevisiae) kolayca transfer edilebilir ve bu hücreler içinde genin ekspresyonu sağlanabilir.
3) Marker aşılar: Bunlar subunit veya gen delesyon sonu elde edilen aşılar arasında yer alırlar ve diagnostik testlerde, aşılı bireylerle, infekteleri veya portörleri saptamada ve birbirinden ayırmada kullanılırlar. Böyle aşılar Veteriner hekimlikte, ulusal sorun yaratan bulaşıcı hastalıkları kontrol altına almada veya eradikasyonunda yararlanılabilir.
Marker aşılar, yabancı ülkelerde sığır ve domuzların herpes virus infeksiyonlarında fazla kullanım alanı bulunmuştur. Bu aşıların esasını, aşı içinde bulunan özel antijenlere karşı hayvanlarda immun respons gelişir, aşıda bulunmayanlara karşı bir antikor oluşmaz. Örneğin, içinde glikoprotein D (gpD) bulunan veya glikoprotein E (gp E) bulunmayan bir aşı ile aşılanan canlının vücudunda sadece gpD'ye karşı antikor oluşur, gpE'ye karşı antikor bulunmaz. Böylece aşı içinde ki subunit bilindiğinden eğer serum da gpD'ye karşı antikor var gpE'ye karşı yoksa hayvan aşılıdır. Çünkü, verilen aşı içinde gpE antijeni yoktur. Eğer serum da gpE'ye karşı antikor saptanırsa, konak, doğal infekte veya portördür.
Buna göre, aşılı hayvanlarla doğal infekte ve portörler saptanabilir ve infekteler sürüden çıkarılabilir.
Bu tür aşılar, aynı zamanda bir bölgeye dışardan giren hastalık ajanlarını saptamada da yardımcı olurlar.
4) Rekombinant mutant aşılar: Bu aşılar, mikroorganizmaların antijenik determinantlarını, komponentlerini ve bazı önemli faktörleri kodlayan genleri, kendi genomlarından çıkardıktan sonra bunları mutant mikroorganizmaların genomlarına integre etmek suretiyle elde edilirler. Örn, BCG, S. typhi Ty21a, S. typhimurium aso SL 3261 vs veya vaccinia virusu genomuna veya diğer mutant viruslara, böyle genler aktarılabilir ve aşı olarak kullanılabilirler. Vaccinia virus genomuna, HBsAg geni, HSV'nin gD geni, influenza virusunun HA geni, kuduz virusun glikoprotein geni, vs. integre edilmiş ve başarılı sonuçlar alınmıştır. Bazen de bir gen yanı sıra birden fazla gen aktarılarak kombine aşılar hazırlanmıştır. E. coli K12 suşu genomuna V. cholerae antijeni veya S. typhimurium 'a (aro SL3261), K88 fimbria, termolabil B toksini geni ve ayrıca M. tuberculosis'in 65kD'luk antijenik determinantı inkorpore edilerek kullanılmıştır.
5) Rekombinant ürünü aşılar: Bu tür aşılarda, mikroorganizmaların antijenik komponentleri çıkarıldıktan sonra alıcı bir hücreye (bakteri, maya) transferi, burada gen ürünü antijenik proteinin ekspresyonunun sağlanması, hücrelerde biriken proteinlerin elde edilmesi ve bunların deneme hayvanlarına verilerek bağışıklık kazandırılması amaçlanır. Bu teknikle bazı bakteri, virus ve parazitlere karşı aşılar hazırlanmıştır.
6) Nukleik asit aşıları (DNA aşıları): DNA aşıları da rekombinant DNA teknolojisi temeline dayalı ve gen mühendisliği yardımıyla elde edilen aşılar arasında yer almakta ve deneme hayvanları üzerinde de ümit verici sonuçlar alındığı açıklanmaktadır.
Son 5-7 yıl öncesine kadar hazırlanan rekombinant DNA aşılarında, klonlanan antijenik proteini taşıyan sekansın (genin) ekspresyonu, genellikle, alıcı bir hücrenin (bakteri veya S. cerevisiae) içinde meydana gelmekte, bu hücrelerden elde edilen ve saflaştırılan protein (antijen), aşılamalarda kullanılmakta idi. Halbuki, nukleik asit aşılarında ise antijenik bir proteinin kodunu taşıyan gen bir ekspresyon plasmidine bağlandıktan sonra doğrudan deneme hayvanlarına verilmekte, genin ekspresyonu vücut içinde gerçekleşmekte, sentezlenen gen ürünü protein de immun sistemi uyararak protektif bir bağışıklık oluşturmaktadır. Böyle aşılamalardan da çok iyi sonuçlar alındığı açıklanmaktadır. Ancak, bu tür aşılar henüz deneme hayvanlardaki uygulamalar düzeyinden kurtarılmış değildir. İnsan ve evcil hayvanlarda başarı ile kullanılabilmesi için daha çok araştırmalara koruyucu bağışıklık durumunun, yan ve toksik etkilerinin incelenmesine, her yönü ile kontrol edilmesine gerek vardır. Bir aşının pratiğe çıkarılmadan önce duyarlı deneme hayvanları üzerinde ve evcil hayvanlarda, gerektiğinde, volunter insanlarda geniş kapsamlı denemeleri yapılmaktadır. Ancak, bazı deneme hayvanlarından alınan sonuçların insan ve evcil hayvanlara tam uymadıkları az da olsa rastlanılan olgular arasında yer almaktadır. Bu nedenle, iyi umutlar vadeden bu yeni aşılar üzerinde çok daha ayrıntılı çalışmaların yapılması ve her yönü ile açıklığa kavuşturulması gereklidir.
Nükleik asit aşıları, şimdiye kadar, insan ve hayvanlarda hastalık oluşturan bazı viral ajanlar (HIV, influenza virusu, hepatit virusları, HSV, kuduz vurusu, retrovirus, CMV, St. Louis encephalomyelitis virusu, bovine herpes virusu, feline immunodeficiency virusu, vs.), bakteriler (M. pulmonis, M. tuberculosis, B. abortus, B.burgdoferi, S. typhi, C. tetani vs.) ve parazitler (P.yoeili, S. japonicum, L. major vs.) üzerinde denenmiştir. Bunların yanı sıra, tümörler üzerinde de bunların, immunolojik yönden kontrol altına alınabilmesi konusunda, çalışmalar yapılmaktadır.
DNA aşılarının hazırlanmaları, kullanılmaları ve vücutta oluşturdukları immunolojik yanıt (humoral, sellüler ve protektif bağışıklık) hakkında bazı gerekli bilgiler aşağıda verilmektedir.
a) DNA aşılarının hazırlanması: Nukleik asit aşılarının hazırlanma stratejisini rekombinant DNA teknolojisi oluşturmaktadır. Bunlarda özetle şöyledir;
i) Hastalık yapıcı mikroorganizmaların vücutta immunolojik bir yanıtı uyaran antijenik komponentlerini (determinantlarını) kodlayan genler, ait oldukları ajanın genomundan enzimler, (restriksiyon endonukleaz) yardımıyla çıkarılır.
ii) Bu spesifik genin 5'-ucuna, ökaryotik hücrelerde etkinlik gösterebilen kuvvetli viral promotor/enhenser sekanslardan biri (CMV, RSV'nin LTR, SV40 promotoru, vs) eklenir. Genin 3'-ucuna da transkripsiyonal terminasyon/poliadenilasyon sekanslar bağlanır.
iii) Böylece hazırlanan konstraktlar, yapısında bakteriyel bir replikasyon orijini (RO, ori) ve antibiyotik rezistenslik geni (ampr, kanr, vs) bulunan bir plasmide bağlanarak rekombinant bir ekspresyon plasmidi (pVC) oluşturulur.
Bu plasmidin taşıdığı genin çok fazla üretilmesi için E. coli 'ye transfekte edilir ve bakteride plasmidin sayısı artırılır. Böylece çok sayıda gen taşıyan plasmid elde edilir. Aksi halde, deneme hayvanlarına verilecek olan plasmide, bakteriyel veya herhangi bir replikasyon orijini ve antibiyotik geni gerekmemektedir. Çünkü, hayvan vücudunda plasmidin çoğalması değil de, taşıdığı genin ekspresyonu amaçlanmaktadır. Bu nedenle denemede kullanılacak ekspresyon plasmidi, vücutta bir uyarım yapabilecek yeteri miktarda (mg veya ng) hazırlanmalıdır.
Ekspresyon plasmidleri, sadece bir antijen geni taşıyabildikleri gibi, bu gen ürününün vücutta daha iyi antijenik olabilmesine yardımcı olan bazı sitokin genleri de (İL-2, BCGF, İL-B1, GM-CSF, vs) katılarak birlikte koekspresyonu sağlanabilir (koekspresyon plasmidleri). Bu ikinci genin her iki ucuna p/e ve t/p sekansları da katılır. Bu sitokinler, adjuvant etkiye sahiptirler (Sitokin adjuvantlar) ve protein antijenlerinin çok daha iyi immunolojik yanıt vermesine destek olurlar. Plasmid DNA'sına, CpG, dinükleotid sekanslarının ilavesinin de immun yanıt üzerine olumlu etkisi olduğu açıklanmıştır.
DNA aşıları yukarda belirtildiği gibi tek bir antijenik genle monovalent olarak hazırlanabileceği gibi, birden fazla antijenik gen de ilave edilerek, aynı anda bir kaç infeksiyona karşı protektif bağışıklık elde edilebilir (kombine aşı). Eğer bir virusun, birden fazla alt tipleri (serotipler) varsa, bunlara ait antijenik komponentler aynı plasmidle monte edilerek bivalan veya multivalan DNA aşıları da hazırlanabilirler.
Multivalan veya kombine aşılar hazırlanırken, bir gen ürününün diğerinin proteinin veya bir birlerinin hücre içindeki ekspresyonlarına mani olmamaları gereklidir.
Plasmid DNA'sına hedef genlerin yanı sıra kostimulatör sekanslarının (B7-1 veya B7-2, vs) katılması halinde, M. tuberculosis hsp 65 veya CEA genlerinin daha iyi antikor sentezledikleri belirtilmiştir. Aksine, İNF-gama geninin antikor titresinde düşmelerine neden olduğu açıklanmıştır.
Plasmid DNA'sının bizzat kendi sekanslarının adjuvant etkisinin olabileceğinden kullanılacak plasmidin çok iyi seçilmesinde yarar vardır.
HBV zarf geni ile İL-2 genini birlikte taşıyan koekspresyon plasmidi (bisistronik ekspresyon plasmidi) vücutta kuvvetli bir Th-1 aktivitesini artırdığı, buna karşın Th-2 etkinliğinin daha zayıf kaldığı belirtilmiştir. Yapılan bir denemede, hücrelerde biriken kuduz virusu glikoproteininin, hücrelerde bazı değişmelere yol açtığı ve bu nedenle de immun responsa olumsuz etkilediği de rapor edilmiştir.
b) Deneme hayvanları: DNA aşılarının deneme hayvanlarında oluşturduğu immunolojik responsun (humoral, sellüler, protektif bağışıklık, vs) derecesini, yan ve toksik etkilerini ve diğer özelliklerini belirlemede, birçok tür deneme hayvanı (fare, kobay, tavşan, ferret, köpek, maymun, vs) kullanılmış ve bunlar içinde, en fazla bağışık yanıt farelerden alındığı için bu hayvanlar fazlaca kullanılmaktadırlar. Deneme hayvanlarının genetik olarak duyarlı ve lenfoid sistemlerinin olgunlaşmış olması aranılan bir durumdur. Yapılan araştırmalar, aşıların, 5-10 haftalık yaştaki farelerde denenmesinin iyi ve etkin bir respons için uygun olduğu sonucunu vermiştir. Ancak, deneme hayvanlarının türü, yaşı ve cinsiyeti, immun yanıt üzerine etkilidir. Bazı antijenler farelerde T-hücrelerini fazla uyarmasına karşın, bir kısım antijen ise B-hücrelerini veya iki hücre türünü de stimule edebilmektedir.
c) Deneme hayvanlarına veriş yolları: Nukleik asit aşılarının in vivo oluşturduğu immunolojik yanıtı, yan ve toksik etkileri ile diğer özelliklerini incelemek üzere çeşitli yollardan (kas içi, intradermal, subkutan, intratraheal, intravenöz, oral, vs.) deneme hayvanlarına verilmiştir. Bunlar içinde pratikliği ve oluşturduğu immunolojik cevap bakımından en uygun 3 yol belirlenmiştir.
i) İntramusküler inokulasyon: Saflaştırılarak hazır duruma getirilmiş ekspresyon plasmid DNA'sının fizyolojik su içinde uygun bir dilusyonu yapıldıktan sonra bacak kası içine şırınga edilir (mikrogram veya nanogram miktarında). Genellikle bir defalık şırınga yeterli bir immunolojik yanıt (humoral, sellüler, protektif) oluşturduğu, bazen ikinci kez şırıngaya gereksinim olabileceği de açıklanmıştır.
Kas içi yapılan şırıngalarda, plasmid DNA'sı miyositlere transfekte olurlar ve bu hücreler tarafından da eksprese edilerek (transkripsiyon ve translasyon) sentezlenen antijenik protein hücre yüzeyine çıkarılarak makrofajlara sunulur.
ii) Deri içine şırınga: Plasmid DNA'sı şırınga ile deri içine verildiğinde yeterli yanıt alınabileceği yapılan çalışmalarla ortaya konulmuştur. Deri içinde keratinositlere transfekte olan plasmid DNA'sı, bu hücrelerce eksprese edilerek, sentezlenen protein, antijen sunan hücrelere (Langerhans, dendritik hücreler ve makrofajlara) presente edilirler.
iii) Dermise gen silahı (gene gun) ile veriliş: Plasmid DNA'sı, çapları, 2-5 mikrometre kadar olan altın mikro partiküllerine adsorbe edildikten sonra, özel bir alet (gen silahı) yardımıyla ve tazyikle deriye aplike edilir. Bu tarz uygulamada dermal keratinositlere plasmid DNA'sının direkt olarak girdiği ve böylece çok kısa sürede genin eksprese ve makrofajlara presente edilebildiği açıklanmıştır.
d) Plasmid DNA'sının ekspresyonu: Aşıların vücutta oluşturduğu, immunolojik responsun derecesi, taşıdığı genin türüne, aşının hazırlanış ve veriliş tarzına, miktarına, deneme hayvanının tür ve yaşına göre değişiklik gösterdiği yapılan çalışmalarda ortaya konulmuştur.
Kas içine yapılan şırıngalarda, sıvı bir ortam içinde verilen plasmid DNA'sı yavaş bir tarzda miyositler içine girerler. Böyle olgu bir transfeksiyondan ziyade, bir transformasyon özelliği taşır. Plasmid DNA'sı hücreye girdikten sonra (bazı yazarlara göre hücre kromozomuna integre olduktan sonra) burada transkripsiyona ve translasyona tabi tutularak gen ürünü antijenik protein sentezlenir (Ekspresyona tabi tutulmayanlar veya genomla birleşemeyenler sitoplasma içindeki endonukleazlar tarafından ayrıştırılır). Miyositlerde MHC-I moleküllerinin bulunması nedeniyle proteinler, bu moleküllerle hücre yüzeyine çıkarılarak CD8+ (CTL) hücrelerine sunulurlar. Bu tarzda uyarılan CTL'ler sitokin sentezlerler ve böylece hücresel bağışıklığı uyarırlar. Ancak, miyositlerde B7-1 yardımcı moleküllerinin olmaması, bu presente olgusunu bir profesyonel APC'ler kadar yapamayacağı kanısını ortaya koymaktadır. Miyositler, daha ziyade, kendileri tarafından sentezlenen, antijenik molekülleri hücre yüzeyine çıkardıktan sonra bunları APC'lere sunarlar. APC'ler bu proteinleri işleyerek ve sonra da MHC-I ve/veya MHC-II molekülleriyle bağlayarak hücre yüzeyine çıkarırlar ve burada, T8+ (CTL) ve T4+ (Th) hücrelerine sunarlar. Böylece uyarılan T-lenfositleri ve sentezledikleri sitokinler hücresel ve humoral bağışıklık mekanizmasını uyarırlar.
Normal koşullar altında, kas dokuda az oranda makrofaj bulunmasına karşın, şırınga sonrası çok az da olsa meydana gelen zedelenmeler bir yangısal reaksiyona ve buna bağlı olarak bu bölgeye makrofajların gelmesine ve sayılarının artmasına neden olur.
Antijen işleyen ve sunan hücreler (makrofajlar, APC) tarafından alınan protein antijenler, kan ve lenf yolu ile sekonder lenfoid organlara (dalak, lenf düğümleri) taşınır ve burada bulunan T-hücrelerine sunularak hem bunların ve hem de sentezlenen sitokinlerle B-hücrelerinin ve diğer hücrelerin uyarılmalarını sağlarlar.
Kas içi şırıngalarda, bu bölgede bulunan makrofajlara da plasmid DNA girebilir. Ancak, bu hücrelerin, direkt olarak DNA'yı eksprese edebileceği görüşü zayıf olarak kabul edilmektedir. Bu nedenle de, plasmid DNA'sının esas eksprese edildiği hücreler olarak kas hücreleri (miyositler) uygun bulunmaktadır.
Makrofajlarca proses edilen ve MHC-I ve MHC-II molekülleri ile bağlanarak hücre yüzeyine çıkarılan polipeptidler, hem T hücrelerini ve hem de bu hücrelerin sentezledikleri sitokinlerde B-hücrelerini uyarabildikleri gibi, B-hücreleri de serbest antijenleri alarak aktive olabilir ve antikor sentezleyebilirler. Uyarılan Th-1'ler, IL-2 ve IFN-gamayı, ve Th-2'ler de İL-4,-5,-6 ve -10'u sentezleyerek B ve T hücre aktivitesini artırırlar. Ayrıca, makrofajlarca sentezlenen İL-1'ler de hem T ve hem de B hücrelerini uyarırlar.
Deri içine yapılan şırıngalarda da esas ekspresyonu sağlayan hücreler olarak keratinositler kabul edilmektedir. Bu hücrelerce sentezlenen antijenik proteinler, Langerhans ve dendritik hücreler ile ayrıca makrofajlar tarafından alınarak MHC molekülleri ile birlikte hücre yüzeyine çıkarılır ve buradan T-hücrelerine sunarlar.
Kas içi şırıngalar yeterli derecede humoral ve sellüler bir yanıt oluşturduğu gibi etkin bir protektif bağışıklık ta meydana getirebilmektedir.
Kas içi şırıngalarda plasmid DNA'sının genellikle mikrogram düzeyinde ve bir kere verilmesi yeterli olabilmektedir (nadiren ikinci kez şırıngaya gereksinim duyulur).
Gen silahı ile epidermal uygulamalar da, plasmid DNA'sı direkt olarak dermal keratinositlerin içine girmekte (transfeksiyon) ve kısa sürede bu hücrelerde eksprese edilebilmektedir. Bu nedenle daha kısa zamanda immunolojik yanıt meydana gelebilmektedir. Sentezlenen antijenler de, yukarda açıklandığı üzere, Langerhans ve dentritik hücreler ile makrofajlara, hücre yüzeyinide sunulmaktadırlar. Gen silahı ile nanogram düzeydeki plasmid DNA'sının yeterli olabileceği açıklanmıştır. Altın partikülleri 10-12 gün içinde deriden (deskuamasiyon sonu) atılmaktadır. Ancak, bazı araştırıcılar, altın partiküllerinin bazen birbirleriyle birleşerek makropartikül oluşturabileceğini ve bunların da keratinositlere zarar vereceğini belirtmektedirler.
Makrofajlar, serbest olarak intersellüler ortamda bulunan antijenleri de alabilirler ve proses edebilirler. Makrofajlar endositozisle aldıkları antijenleri dalak ve lenf düğümlerine taşıyarak buralarda bulunan lenfoid ve miyeloid sisteme ait hücrelerin uyarılmalarına ve aktivitesine neden olurlar.
Genlerin ekspresyonlarını sağlayarak antijen sentez eden ve sunan hücreler, genellikle, proses ve presente eden hücreler için birer antijen deposu (kaynağı) görevini yapabilmekte ve uzun süre uyarıma destek olabilmekte ve devam ettirebilmektedir.
Kas içi Şırınga ile Dermal (gen silahı ile) Uygulama Arasındaki Başlıca Farklar
1) Kas içi daha fazla (mikrogram, 40-50, düzeyde) antijen verilmektedir. Buna karşın gen silahı ile nanogram (1-10) miktarlar yeterli olabilmektedirler.
2) Kas içi şırıngalarda, fizyolojik su içinde serbest olarak bulunan plasmid DNA'sının miyositlere girişi daha yavaştır (transfeksiyondan ziyade, transformasyon gibi). Bu nedenle de, immunolojik yanıt daha geç başlamakta ve hücreler içine giren plasmid DNA miktarları da genellikle az olmakta ve hatta bazı hücrelere de girememektedirler. Hücre içindeki nukleazlar tarafından da ayrıştırılabilmektedirler.
Gen silahı ile yapılan uygulamalarda keratinositlere direkt olarak ve fazla miktarda da plasmid DNA'sı girebilir ve kısa sürede eksprese edilebilir.
3) Kas içi şırıngalar daha ziyade Th-1 hücrelerini uyarmakta ve bunlar da predominant olarak İL-2, IFN-gama sentezlemektedirler ve gen silahı ile uygulanmalar ise Th-2 hücrelerini stimule etmekte ve bunlarda daha ziyade İL-4,-5,-6,-10 sentezlenmektedirler. Gen silahı aynı zamanda, kas içi uygulamadan daha fazla CTL responsu oluşturmaktadır.
4) Kas içi uygulamalar daha kolay ve ucuzdur. Şırınga bulmak her zaman olasıdır. Gen silahını temin etmek güç olduğu gibi pahalı ve uygulanması için özel beceri gerektirir.
5) Altın mikropartikülleri daha büyük olurlarsa veya birbirleriyle birleşirseler hücrelerde zedelenmelere yol açarlar.
Nükleik asit Aşılamalarına Etkileyen Başlıca Faktörler
1) Seçilen genin kodladığı proteinin antijenitesi veya immunojenitesi,
2)Aşıların hazırlanma teknolojisi (ekspresyon plasmidinin hazırlanması, promotor ve terminatör sekanslar, vs),
3) Plasmid DNA'sına sitokin adjuvant genlerinin, kostimulatör veya diğer genlerin inkorpore edilmesi,
4) Ekspresyon için kullanılan promotor/enhenser sekanslarının gücü ve türü,
5) Kullanılan deneme hayvanının ırkı, türü, yaşı, cinsiyeti,
6) Deneme hayvanlarının genetik duyarlılığı ve yetiştirme yönü (konvansiyonel, SPF, germ free).
7) Deneme hayvanlarına veriliş yeri (kas içi, deri içi, gen silahı ile dermal uygulama)
8) Verilen aşının miktarı
9) Aynı plasmide integre edilen değer genlerin ürünlerinin esas gen ürünü ile olan veya hücrelere olan etkileri, etkileşimleri (interaksiyonu),
Nukleik Asit Aşılarının Avantajları
1) Çok az miktarlarda kullanılır (mg ve ng),
2) Uzun süreli antijen ekspresyonu sağlayabilirler,
3) Sellüler ve humoral yanıt, bellek hücreleri, protektif immunite oluşumuna yol açarlar,
4) Yan ve toksik etkileri yok (veya yok denecek kadar az),
5) DNA aşıları, vücutta önceden bulanan maternal veya aktif immunizasyona ait antikorlardan etkilenmezler (veya çok az etkilenirler) ve bu bariyeri aşabilirler. Böyle antikor taşıyan bireyleri aşılamak olanaklarını da sağlarlar
6) Soğuk zincire pek fazla gereksinim duymamaktadırlar,
7) Uzun süre kullanma ve muhafaza olanağı sağlarlar,
8) İyi yetişmiş teknisyenler tarafından kolayca ve fazla miktarlarda hazırlanabilirler,
9) Kolay uygulanabilirler (kas içi),
10) Viral, bakteriyel ve parazitlere karşı hazırlanabilirler,
11) DNA aşılarının fizikokemikal stabilitesi, saflığı, kolay hazırlanması, miktarı oluşturduğu immun yanıt ve diğer bazı yönlerinden konvansiyonellere oranla, belirgin bir üstünlüğü var sayılmaktadır.
Nükleik Asit Aşılarının Dezavantajları
1) İyi ve donatılmış bir biyoteknoloji laboratuvarına ve yetişmiş, bilgili ve becerili teknik elemanlara gereksinim vardır,
2) Otoimmuniteye çok nadir de olsa rastlanma olasılığının bulunması (Aşırı uyarım ve ekspresyon, ototoleransı bozarak otoimmun hastalıklara yol açma durumu ortaya çıkabilir),
3) Plasmid DNA'sı, konakcı hücre genomuna integre olduğunda önemli bir genin inaktivasyonuna veya taşıdığı kuvvetli promotorlar nedeniyle bazı protoonkogenlerin aşırı uyarımına ve ekspresyonuna neden olarak tümorigenezise yol açma olasılığı bulunabilir,
DNA aşılarının inaktif aşılardan çok daha fazla etkin (100-200 defa fazla) oldukları belirtilmektedir. Kas içi uygulanan aşılamalardan sonra yapılan gen DNA'sı araştırmalarında, plasmid DNA'sının kas hücrelerinde bulunduğu ve diğer hücrelerde olmadıkları belirlenmiştir. Bu durum miyositlerin devamlı antijenik uyarım yapacak bir role sahip olduğunu düşündürmektedir.
Aşılamalar sonunda İgG ve İgM antikorları fazla olmasına karşın sIgA'lara mukozal yüzeylerde çok az rastlanıldığı açıklanmıştır. Farelerde İgG2a predominant antikor olarak ortaya çıkmaktadır. DNA aşıları katyonik lipid kompleksleri ile birlikte kas içi verildiklerinde veya PLGA mikrosferlerinde kapsüle edildikten sonra oral kullanıldığında sİgA'lara rastlanıldığı açıklanmıştır.
Hücre içinde genin ekspresyonunu artırmak için, çok kuvvetli promotorların kullanılması nadiren de olsa olumsuz sonuç vermektedir. Bazen, çok fazla sentezlenen proteinler hücrelerde dejenerasyonlar yapabilir (bu olumsuz etki genin kodladığı proteine göre değişebilir) ve böylece sentez yavaşlar ve glikoproteinin üretiminde azalmalar görülür. Böyle durumlarda glikoprotein geni daha küçük sekanslara bölünerek kullanılmasının yararlı olacağı belirtilmektedir.
Antiviral Serumlar
Canlıları pasif bağışıklıkla korumada başlıca antiviral immun serumlar ve gama globulinlerden yararlanılmaktadır.
İmmun serumlar, genellikle, şahıslarda ve hayvanlarda hazırlanarak, hastalara verilmek suretiyle sağaltım ve sağlamlara da koruyucu amaçla kullanılırlar. Böyle serumların başında kuduz, tetanoz, difteri, vs. serumu bulunmaktadır.
Gama globulinler de, immun serumların fraksiyone edilerek gama globulinlerinin ayrılması sonu elde edilirler. Bunlar da, aynı amaçlar için kullanılırlar.
04.Antiviral İlaçlar
04.01. Antiviral Kemoterapötikler
Bakterilerin canlılardaki zararlı etkinliğini gidermek, bakterileri öldürmek ve üremelerini inhibe etmek için kullanılan antibakteriyel ilaçlar, kemoterapötikler, özellikle antibiyotikler, viral infeksiyonlarda proflaktik veya terapötik amaçla kullanılamazlar. Çünkü, viruslara etkili değildirler. Bakteriler sıvı veya katı, canlı veya cansız ortamlarda, kolaylıkla üreyebilecek her türlü olanağa ve düzene sahiptirler. Çünkü bakteriler başka hücrelere gereksinimleri olmadan kendilerinde bulunan replikasyon ve ekspresyon mekanizmaları ile DNA'larında bulunan genetik kodlarla her türlü makro ve mikro molekülleri, proteinleri, enzimleri, karbonhidrat, lipid ve diğer organik bileşikleri sentezleyebilir ve çoğalabilirler. Dolayısıyla da bu aşamalara etkileyen antibakteriyel ilaçlar, bakterilere de zarar verir ve öldürür. Halbuki, viruslar böyle değildir. Virusların yapısı daha basittir. Viruslar kendi komponentlerinin (genetik materyal, kapsid, zarf, vs.) sentezi ve asamblesi için kendi dışındaki canlı hücrelerin replikasyon ve ekspresyon mekanizmalarına, enzimlerine, proteinlerine ve diğer moleküllerine ihtiyaç gösterirler. Bu nedenle bu sentez mekanizmasına etkileyen antibiyotikler de hücrelere zarar verir ki bu da birçok yan ve toksik etkilere yol açar. Böylece bireyler zarar görürler.
Viral replikasyon denince sadece, nukleik asitin propagasyonu anlaşılmaz daha geniş bir anlam taşır. Şöyle ki, bu terim, virusun adsorbsiyon, penetrasyon, kapsid ve/veya zarftan ayrılma, transkripsiyon, translasyon, viral proteinlerin sentezi, asamble ve hücreden çıkış aşamalarını da içine almaktadır. Bu safhaların hepsinde hücrelerin ve konakcı rolünün olması nedeniyle aşamaların birine mani olan ilaç az veya çok hücrelere de olumsuz yönde etkilemektedir. Ayrıca, virusların yapıları ve replikasyon tarzları da virus gruplarına göre değişmektedir.Şöyle ki, virusların, DNA veya RNA'ları, tek iplikçikli veya çift iplikçikli çıplak veya zarflı, sirküler veya lineer gibi değişik özellik taşımaları, bunların replikasyon aşamalarının da farklı karakter göstermesine yol açmaktadır. Bu nedenle, bu basamakların her birine etkileyecek ilaç da, virus grupları arasında değişmektedir.
Viral infeksiyonları önlemede, proflaktik ve terapötik amaçla kullanılacak ilaçların, virus replikasyonunun her aşamasına etkili olması ve buna karşın konakcı hücrelerine bir zararlı etkisinin (yan ve toksik etki) olmaması istenen önemli noktalardır. Ayrıca, ilaçların virusidal olması, dirençlilik oluşturmaması, yan ve toksik etkilerinin de mümkün olduğu kadar az olması veya olmaması arzu edilen diğer önemli hususlar arasındadır. Ancak, şimdiye kadar böyle kriterlere tam uyabilecek bir antiviral madde elde edilememiştir.
Koruma ve sağaltımda göz önünde tutulması gerekli konulardan biri de, kuşkusuz, viral infeksiyonların karakteridir. Viruslar konakçıda başlıca 3 tür infeksiyon oluştururlar.
1) Litik infeksiyonlar: Bu tür infeksiyonlarda viruslar çok çabuk üreyerek hücreleri parçalar ve etrafa yayılırlar. İnfeksiyon perakut veya akut seyreder ve klinik belirtiler de genellikle barizdir. Ancak, perakut olgularda, infeksiyonun çok hızlı seyretmesi nedeniyle özel semptomlar tam ortaya çıkmayabilir. Bunun için zaman çok yeterli değildir. Genel semptomlar (baş ağrısı, halsizlik, ateş, iştahsızlık, durgunluk, vs.) ön plandadır.
Litik infeksiyonlarda korunma ve sağaltım ön planda olmalı, erken teşhis, doğru bir ilaç seçimi ve yeterli sürede kullanılması hastalığın proflaksisinde ve sağaltımında önemli rolü vardır.
2) Persistent infeksiyonlar: Bazı viruslar hücrelerde yavaş ürer, tomurcuklanarak olgunlaşır ve dışarı çıkar. Bu aşamalar virus gruplarına göre uzun veya kısa sürebilir. Böyle infeksiyonlarda, genellikle, hücrelere bir zarar gelmez, hücreler canlıdır ve üremelerine devam ederler.
Viruslar da devamlı ve yavaş üreyerek tomurcuklanma ile hücreden dışarı çıkarlar. İnsanlardaki Hepatitis B virusu, insan Leukemia virusu (HLV), insan immundeficiency virus (HIV), myxoviruslar, vs. bu tarzda infeksiyon oluşturanlardan bir kaçıdır.
Bu infeksiyonlar yavaş başlar ve uzun sürer (subakut veya kronik) konakcı devamlı portör halindedir. Klinik belirtiler yetersiz, teşhis güç ve sağaltımda da genellikle geç kalınır. Böyle infeksiyonlarda korunma önemli olmakla beraber, etkenin türüne yönelik bir ilaçla sağaltımın da önemi vardır.
3) Latent infeksiyon: Bu tür infeksiyonlarda, viral nukleik asit, konakcı hücre DNA'sına integre olur, onun bir parçası ve devamı haline gelir, hücre ile birlikte replike olarak kardeş hücrelere transfer edilir fakat hücrelere bir zarar vermez ve hayat boyu konakcıda kalabilir. Retroviruslar, bazı herpes virusları, Varicella zoster, CMV, EBV, vs. gibi. Ancak, konakçının stres altında kalması veya indüktörlerin etkisinde bulunması virusların aktivasyonuna, konakcı hücrelerine zarar vermesine ve hastalık oluşturmasına yol açabilir.
Teşhis, biyoteknolojik yöntemlerle yapılır. Şöyle ki, konakcı hücre DNA'sında yabancı DNA (viral DNA) aranır.
Böyle infeksiyonları ortaya koymak mümkün olmadığından, virus taşıyanları da saptamak oldukça zordur. Bu nedenle koruyucu önlemlere fazla dikkat edilmelidir.
Son yıllarda, antiviral maddeler üretmede üzerinde durulan noktalardan biri de, biyoteknolojik yöntemlerden de yararlanılarak virusların kodladığı ve replikasyonları için önemli olan enzimlerin (transkriptase, replikase, revers transkriptase, protease, vs.) inhibitörlerini saptayarak üretmek ve bunları kullanmak yönündedir. Diğer önemli konu da, X-ray kristalografik yöntemlerle belirlenen ve virusları yüzeyindeki özel ligandların yerlerinin saptanarak karakterize edilmesi ve bunları etkisiz hale getirecek kimyasal maddelerin hazırlanması ve kullanılmasıdır. Veya antisens oligomerler veya ribosim teknolojileri kullanılarak böyle reseptörleri kodlayan genlerin etkisiz hale getirilmesidir. Buna alternatif olarak da, virusların yüzeyindeki ligandlara bağlanarak, bunların hücre üzerindeki viral reseptörlerle birleşmesini önleyen ve nötralize eden ilaçların dizaynının yapılması ve kullanılabilecek hale getirilmesidir. Bazı viruslarda da (HIV, vs.), viral genomda, birçok regülatör genlerinin bulunduğu belirlenmiştir. Bu gen ürünlerine ve/veya kodlayan sekanslardaki özel tanıma bölgelerine bağlanan ilaçların da viral replikasyonu önleyebileceği ileri sürülmektedir
Son zamanlarda geliştirilen ve viral infeksiyonların önlenmesinde etkinliği henüz laboratuvar aşamasında olan antisens oligonukleotid ve Ribozim teknolojileridir. Geliştirildiğinde ileride ümit vadeden biyoteknolojik yöntemlerdir.
Viral infeksiyonlardan korunma ve sağaltımda İnterferonlar da (IFN-a ve -b ) son 10 yıl içinde denenen önemli antiviral substanslar arasında bulunmaktadır.
Viral hastalıklardan korunma klasik aşılar (aktif-inaktif) ve biyoteknolojik aşılar giderek önem kazanmaktadır ve etkinliklerini sürdürmektedir. Pasif bağışıklık amacıyla da immun serumlar ve gamaglobulinlerden de fazlaca yararlanılmaktadır.
Antiviral kemoterapide kullanılan bazı ilaçların adları ve özellikleri aşağıda özetle belirtilmiştir.
Amantadine (a - adamantanamine): Bu ilaç, İnfluenzae A virusuna etkili olup daha ziyade virusun zarftan çıkışına ve dolayısıyla da transkripsiyon ve translasyonuna mani olur. İlacın İnfluenza insidensini %50-70 azalttığı bildirilmiştir.
İnfluenza infeksiyonlarda koruyucu amaçla kullanılmaktadır. İlaca dirençli suşların ortaya çıktığı rapor edilmiştir. Yan etkileri (sinirlilik, baş ağrısı, insomnia) de olmakla beraber tolere edilebildiği açıklanmıştır.
Arildone ve Rhodanine: Bu antiviral maddeler de, sıra ile poliovirusuna ve echovirus-12'ye etkili olup viral membranlardan nukleik asitlerin çıkmasını inhibe ederler.
Acyclovir (acycloguanosine): Herpes virusları, VSV ve EBV etkili olan acyclovir, yan ve toksik etkileri çok azdır. İlaç, DNA polimerase enzimini inhibe ederek virusun DNA sentezine mani olur.
Adenine arabinoside ve Cytosine arabinoside: Bu antiviral substanslar herpes viruslarına etkilidir ve DNA polimeraz inhibitörleridir.
Foscarnet (foscavir): Bu preparat, herpesvirusları ve hepatit viruslarında polimeraz enzimini inhibe eder.
Gancyclovir: Bu ilaç da yapı ve etki bakımından Acyclovire benzer.
Ribavirin: Bir nukleosid analoğu olan Ribavirin viral replikasyona mani olur. İlaç Influenzae A ve B ile respirator sinsiyal virus infeksiyonlarında etkilidir.
Yan (kemik iliğini zedeler) ve toksik etkileri vardır. Kısa aralıklarla (4 saatte bir) kullanılır. Doz iyi ayarlanırsa bu olumsuz etkiler tolere edilebilir.
Rifampin:Reoviruslarında reverstranskriptazın aktivitesini önleyen bir etkinliğe sahiptir.
Rimantadine: Bu ilacın etkisi de Amantadine benzemekte ve İnfluenzae A virusunun proflaksisinde kullanılmaktadır.
Zidovudine (Azidothymidine, AZT): Bu ilaç daha ziyade AIDS'in sağaltımında kullanılmaktadır. İlaç, virus tarafından kodlanan revers transkriptaz enzimini inhibe eder ve böylece replikasyonuna mani olur. Yan ve toksik etkileri vardır.
Dideoxynosine (ddI): Revers transkriptase enzimini inhibe ettiği için AIDS'ın tedavisinde kullanılır. Kemik iliğine zararlı etkisi AZT'den daha azdır.
Dideoxycytidine (DDC): Revers transkriptazı inhibe ettiği için etki yönünden AZT ve ddI'ye benzer.
İnterferonlar (IFN): Leukosit ve fibroblastlar tarafından sentezlenen IFN- a ve -b'nın antiviral bir etkisi vardır. Ancak, bazı viral infeksiyonda yararlı olmamaktadır. Kronik viral hepatitis ve human papillomatosisde kullanılmıştır. Ayrıca, Kaposi sarcomada da denenmiştir.
Viral aşılar ve immunserumlar: Bunlar hakkında "viral aşılar" kısmında gerekli bilgi verilmektedir.
Yukarda bildirilen antiviral ilaçlardan ayrı olarak, Isatinthiosemicarbazone (IBT), 2-hydroxybenzyl benzimidazole (HBB), 5-iododeoxyuridine (IDU), trifluorothymidine (F3T), phosphonoacetic acid, phosphonoformic acid, vs. gibi preparatlar hazırlanmış ve denenmişlerdir.
05. İnterferon (İfn)
İnterferon, vücutta antikor sentezinden önce Leukosit ve fibroblastlar tarafından üretilen, düşük molekül ağırlığına sahip, nonspesifik ve genellikle, indirekt etkili antimikrobial substanslardır.
Şimdiye dek başlıca 3 tür interferon belirlenmiştir. Bunlardan, alfa ve beta interferonlar leukosit ve fibroblastlar tarafından sentezlenir ve antimikrobial bir etkinliğe sahip olmasına karşın, gama interferon (immun interferon) ise uyarılmış yardımcı T hücrelerince ( T 4, Th) oluşturulurlar ve bunların hücresel bağışıklıkta önemli fonksiyonları bulunmaktadır. Gama interferonlar, immun sistem hücrelerini (B-, T-, CTL, NKC, makrofaj, leukosit, vs.) uyardığı gibi, bu hücrelerin yeni yüzey molekülleri (MHC, FcR, vs.) kazanmasında da rolleri vardır. Buna karşın, antimikrobial etkinliği yoktur.
İnterferonlar sadece viruslar tarafından değil, bakteri, mantar, parazit, protozoon, mitojenler, sentetik polimerler (polisülfat, polifosfat, vs.) gibi substanslar da İFN sentezini indükleyebilmektedirler. Ayrıca, inaktive edilmiş (UV-ışınları, mutajenler, vs ile) viruslar da İFN sentezine yol açabilmektedirler.
İnsanlarda İFN geni 9.kromozomda lokalize olmuştur ve gende intron bulunmamaktadır (165-166 amino asitlik bir protein). Alfa İFN glikoz molekülü taşımamasına karşın diğerleri glikoprotein yapısındadır. Molekül ağırlıkları da 16000 - 25000 arasında değişmektedir. İnfeksiyondan 6-10 saat sonra veya antikor sentezinden önce üretilirler ve antikorlar kanda yükselmeye başlayınca da, İFN molekül sayısı da azalmaya başlar. Antikor aktivitesine sahip olmayan İFN'lar, kendilerinin sentezini indükleyen etkenden ziyade, kendisini üreten hücre türüne spesifiktirler. Yani, bir virus tarafından indüklenen İFN, sadece o virusa karşı değil diğer viruslara da etkili olabilmektedir. Bu nedenle de nonspesifik bir fonksiyona sahiptirler. Ancak, hangi canlının ve ne tür hücresi (epitel, fibroblast, vs.) kullanılmışsa, bunlara ait infeksiyonlarda etkilidirler. Bu nedenle de hücrelere spesifitesi daha fazladır. Antikorlardan en önemli farkları, antikorların, kendi sentezini uyaran etkenlere karşı çok spesifik olmaları ve genlerinin de ayrı kromozom üzerinde ve farklı sekanslara sahip olmasıdır. Ayrıca, etkinlikleri yönünden de aralarında farklar vardır.
Son yıllarda, İFN üretiminde hibridoma ve rekombinant DNA teknolojisinden fazlaca yararlanılmakta ve bol miktarda üretimi gerçekleştirilmektedir. Örn, E.coli 'de İFN başarılı bir şekilde üretilmektedir.
İFN'ler insan hekimliğinde viral infeksiyonlarda ve kanserin sağaltımında denenmiştir. İnsanlarda İFN'lerin etkili olabilmesi için, önce human orijinli İFN olması ve hücrelerde virus replikasyonunun başlamaması gereklidir. Ayrıca, veriliş yolunun, miktarının (dozu), süresinin önemleri oldukça fazladır.
İFN'lerin antimikrobial etkileri daha ziyade indirekttir. Yani, infekte hücrelerde sentezlenen İFN'ler bitişiğinde bulunun hücrelere girdikten sonra, bu hücrelerde, viruslara etkili antiviral proteinlerin sentezine yol açar ve bu proteinler hücreleri viral infeksiyondan korur. Ancak, şu nokta da önemlidir. Viruslar hücrelerin replikasyon ve ekspresyon mekanizmalarını kullandığından, viral infeksiyonlarda yavaş üreyen viruslarda IFN sentezleyen sistemin zedelenmemesi önemlidir. Bu bakımdan, yavaş üreyen viruslar veya persistent infeksiyon meydana getirenler, litik infeksiyonlardan daha fazla İFN oluşumuna yol açarlar.
Yandaki şekilde İFN sentez mekanizması şematik olarak gösterilmektedir. | 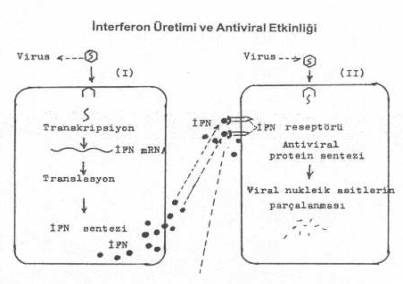 |
[1] Kaynak: Temel Mikrobiyoloji