Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji1
01. Genel Bilgiler
02. Karbonhidrat Metabolizması
02.01. Monosakkaridler
02.02. Disakkaridler (C12H22O11)
02.03. Trisakkaridler (C18H32O16)
02.04. Polisakkaridler (C6H10O5)n
02.05. Alkoller
02.06. Glikozitler
02.07. Karbonhidratların Ayrışması
02.08. Karbonhidratların Sentezi
03. Lipid Metabolizması
03.01. Lipidlerin Ayrışması
03.02. Lipidlerin Sentezi
04. Protein Ve Amino Asit Metabolizması
04.01. Proteinlerin Ayrışması
04.02. Amino Asitlerin Hidrolizasyonu
04.03. Amino Asitlerin Sentezi
04.04. Peptidlerin Sentezi
05. Nukleik Asitlerin Metabolizması
05.01. Nukleik Asitlerin Sentezi
05.02. Nukleik Asitlerin Ayrışması
06. Enerji Metabolizması
06.01. Elektron Transportu
07. Metabolizma Regulasyonu
07.01. Genel Bilgiler
07.02.Enzim indüksiyonu
07.03. Lak-Operon Ve Regulator Genleri
07.04. İ- Geni (Regulatör Gen) Ve Represör
07.05. Promotor (P)
07.06. Operatör (O)
07.07. Katabolik Represyon
07.08. Son Ürün İnhibisyonu (Feedback inhibisyon)
07.09. Allosterik Proteinler
07.10. Enerji Kontrolü
07.11. Nukleik Asit Sentezlerinin Regulasyonu
01. Genel Bilgiler
Mikroorganizmaların yaşamaları, büyüme, gelişme ve üremeleri için beslenmeleri ve bu nedenle de bulundukları ortamlardan gerekli besin maddelerini almaları şarttır. Bakterilerin gıda maddelerinden yararlanabilmesi, bunların, hücre duvarından ve sitoplasmik membrandan geçebilmesine bağlıdır. Dış ortamda veya çevrede bulunan ve hücreye yarayışlı maddelerin molekülleri, genellikle, büyük olduğundan hücre duvarından geçemezler. Bunların aktif transportla geçebilecek bir düzeye indirilmeleri gereklidir. Bu görevi, bakteriler tarafından sentezlenen ve dışarı verilen hidrolizan enzimler (ekzoenzim) yerine getirirler.
Mikroorganizmaların dışındaki ortamda ekzoenzimler yardımı ile hücre membranlarından geçebilecek boyutlara indirilen gıda maddeleri (protein, karbonhidrat, lipid, v.s.), içeri girdikten sonra da, sitoplasma içinde, ayrışmasına devam edebilir ve en küçük yapı taşlarına dek ayrışabilirler. Lüzumlu olduğu durumlarda da fazla ayrışmadan üniteler halinde hücre içinde ve özel depolarda tekrar kullanılmak üzere muhafaza edilebilirler. Sitoplasmada devam eden ayrışma olaylarını, içerde kalan ve dışarı bırakılmayan, endoenzimler katalize ederler (disimilasyon-katabolizma). Mikroplar, sonradan bu yapı taşlarından veya daha büyük moleküllerden, kendilerine lüzumlu olan maddeleri (protein, polisakkarid, lipid, enzim vs.) sentezler (asimilasyon-anabolizma). Bu iki ve çok önemli olan ve birbirini izleyen biyokimyasal olay, bakterilerde metabolizmayı oluşturur. Metabolik olaylar, bir çok enzimlerin katalitik etkisiyle basamak basamak ve ardışık olarak yönetilir. Enzimlerde oluşabilecek en küçük değişmeler, bu çok önemli ve seri biyokimyasal olayların bozulmasına veya yön değiştirmesine neden olurlar.
Üremekte olan hücrelerde metabolizma olayları devamlıdır ve birbirleriyle ilişkilidir. Anabolizma ile hücre tazelenir, tükenmiş olan ve lüzumlu bileşikler sentezlenir. Katabolizma da ise, sentez için gerekli enerji ve yapı taşları hazırlanır. Gıda azlığı, kuruma, sporlanma, minimal ısının altında bulunma, kimyasal mikrobistatiklerin etkisi, vs. diğer nedenlerle metabolizma azalacağı gibi donma olaylarında da tamamen durabilir.
Katabolizma olaylarında gıda maddelerin ayrışması sonu önemli miktarda enerji açığa çıkar (ekzergonik reaksiyonlar) ve bu enerji, yüksek enerji bağları halinde, ADP (adenosin difosfat) ve ATP (Adenosin trifosfat) tarafından alınarak kendi fosfat bağları arasında muhafaza edilir. Sentez olayları için gerekli olan enerji bu bağlardan sağlanarak yürütülür (endergonik reaksiyonlar).
Mikroorganizmalarda metabolizma başlıca üç temel grupta incelenir. Bunlar da;
1) Karbonhidrat metabolizması,
2) Lipid metabolizması,
3) Protein ve amino asit metabolizması.
02. Karbonhidrat Metabolizması
Karbonhidratlar, karbon (C), hidrojen (H) ve oksijenden (O) oluşmuş organik bileşiklerdir. Bu komponentler, kendi aralarında (CH2O)n oranında bir araya gelmişlerdir. Karbonhidratlar heterotrofik mikroorganizmalar için enerji kaynağı ve karbonları da organik bileşikleri sentezlerken yapı taşları olarak görev yaparlar. Karbonhidratlar yapılarında bulunan (karbon atomları sayısına göre) kısımlara ayrılırlar. Mono ve disakkaridler (şekerler) suda kolayca erir, kristalize ve diyalize olabilirler. Buna karşılık polisakkaridler, suda erimezler ve diyalize de olmazlar.
02.01. Monosakkaridler
Ampirik formülü (CH2O)n olan monosakkaridler, karbon atomlarına göre, kendi aralarında klasifiye edilirler. Triose (C3H6O3): Gliseraldehid; Tetrose (C4H8O4): Eritroz; Pentoz (C5H10O5): Arabinoz, ksiloz, ramnoz, riboz. Riboz ve deoksiriboz nukleik asit moleküllerinde bulunması bakımından önem taşırlar. Hekzoz (C6H12O6): Galaktoz, glukoz, fruktoz, mannoz. Glukoz kolayca fermente olabilmesi nedeniyle hücreler için iyi bir karbon ve enerji kaynağıdır.
02.02. Disakkaridler (C12H22O11)
Disakkaridler, iki monomer monosakkaridin su kaybederek kondenzasyonu sonu meydana gelirler. Önemli disakkaridler arasında, laktoz, maltoz, sakkaroz, sellobioz, trehaloz vardır.
Laktoz : glukoz + galaktoz
Maltoz : glukoz + glukoz
Sakkaroz : glukoz + fruktoz
02.03. Trisakkaridler (C18H32O16)
Bunlar üç monosakkaridden oluşmuşlardır."
Rafinoz : galaktoz + glukoz + glukoz
02.04. Polisakkaridler (C6H10O5)n
Bunlar birçok monosakkarid moleküllerinin su kaybederek kondenzasyonu sonu oluşurlar. En önemli homopolisakkaridler arasında, dekstrin, glikojen, inulin, nişasta, sellüloz ve heteropolisakkaridlerden de mukopolisakkaridler (hyaluronik asit) vardır.
Nişasta glukoz monomerleri yandaki şekilde gösterilmiştir. | 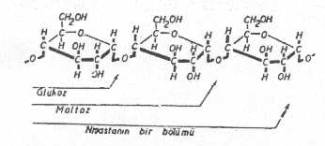
|
02.05. Alkoller
Adonit, dulsit, eritrit gliserin, inosit, mannit,
02.06. Glikozitler
Amigdalin, eskülin, salisin.
02.07. Karbonhidratların Ayrışması
Karbonhidratların disimilasyonu, polisakkarid ve monosakkarid olduklarına göre, aşağıdaki tarzda meydana gelir.
A) Polisakkaridlerin ayrışması: Polisakkaridler, birbirlerine glikozid bağla bağlanmış, monosakkarid ünitelerinden oluşmuş yüksek molekül ağırlığına sahip organik polimerlerdir. Monomerler arasındaki glikozid bağın çözülmesi, polisakkaridleri, kendilerini oluşturan ünitelere ayrılmasına yol açar. Bu da başlıca iki tarzda oluşur:
1- Hidrolizasyon: Monosakkaridleri birleştiren glikozid bağı, mikroorganizmalarındaki özel enzimler (karbonhidrase) tarafından, su aracılığı ile çözülerek, koparılır. Böylece polisakkarid ayrışır.
Örneğin,
amilase
Nişasta + H2O ----------à maltoz
maltase
Maltoz + H2O ----------à glukoz + glukoz
sellülase
Sellüloz + H2O -----------à sellobioz
sellobiase
Sellobioz + H2O -----------à glukoz + glukoz
Maltozun hidrolizasyonu yandaki şekilde gösterilmektedir. | 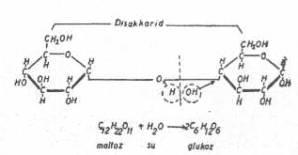
|
Nişasta ve glukojeni iki amilase (alfa ve beta) ayrıştırır. Alfa-amilase nişastayı dekstrine ve beta-amilase da maltoza kadar hidrolize eder. Alfa-amilaza basil, klostridium ve pseudomonaslarda rastlanmıştır. Beta-amilase çok nadiren bulunur. B. polymyxada her iki tür amilaza tesadüf edilmiştir. Sellülozu birçok bakteriler (rumen mikroorganizmaları, Myrothecium verrucaria) ayrıştırabilirler. Cellovibrio gilvas 'ın sellülase enzimi, beta-amilaza benzer.
Bir heteropolisakkarid olan hyaluronik asit, birçok bakteride (streptokok, stafilokok, diplokok, klostridium, vs.) bulunan hyaluronidase enzimi aracılığı ile hidrolize edilir.
Bir disakkarid olan laktoz, E. coli 'de bulunan beta-galaktosidase enzimi tarafından ayrıştırılır.
2- Fosforilasyon: Mikroplarda bulunan polisakkarid fosforilase enzimleri, polisakkaridlerin ayrışmasına yardımcı olurlar. Bu reaksiyon, reversible olduğundan, karbonhidratların sentezinde de görev alır. Klostridium, streptokok, Neisseria, korinebakteriler ve agro-bakterler böyle enzime sahiptirler. Bu enzimler, polisakkaridlerin, fosforilasyonla ayrışmasını katalize ederler. Örneğin,
maltoz fosforilase
Maltoz+ H3PO4 ----------àbeta - D-glukoz -1- fosfat + glukoz
sellobioz fosforilase
Sellobioz+ H3PO4 --------------à alfa-D-glukoz-1-fosfat + glukoz
B) Monosakkaridlerin ayrışması: Monosakkaridlerden glukoz, diğer karbonhidratların yapısında bulunması bakımından çok önemli ödevi ve yeri vardır. Glukoz bakteri hücre zararlarından içeri girdikten sonra, ya glukoz olarak özel depolarda muhafaza edilir veya ayrışmaya devam ederek, ayrışmanın karakterine göre (aerobik veya anaerobik), son ürünlere kadar bölünür. Ayrışma tarzı ve buna bağlı olarak oluşan son ürünler mikroorganizmalar arasında çok değişiklik gösterir. Bunlardan yararlanılarak mikropların identifikasyonuna çalışılır. Heterotrofik mikroorganizmalar tarafından glukozun ayrıştırılması sonu oluşan son ürünler aşağıda gösterilmiştir:
a) Organik asitler: Asetik asit, butirik asit, formik asit, kojik asit, laktik asit, propionik asit, pirüvik asit, suksinik asit, vs.
b) Nötral ürünler: Asetil metil karbinol, aseton, butil alkol, 2,3-butilenglikol, diasetil, etil alkol, isopropil alkol, n-propil alkol, v.s.
c) Gazlar: Hidrojen, karbondioksit, metan
Bazı mikropların glukozu ayrıştırması sonu oluşan son ürünler yandaki şekilde gösterilmektedir. | 
|
Aerobik, fakültatif ve anaerobik mikroorganizmalar, glukozu değişik tarzda ayrıştırarak son ürünler meydana getirirler: Glukozun son ürünlere dek ayrışması, bir tek basamakta olmayıp, bir seri reaksiyonları kapsar. Her basamak, bağımsız olup ayrı ve özel enzimler tarafından katalize edilirler. Reaksiyon aktive edildikten sonra başlayınca, diğer basamaklar ardışık olarak birbirini izler.
Glukozun aerobik veya anaerobik ayrışması sırasında, temel bir ürün olan pirüvik asit oluşur. Bu nedenle de ayrışmalar, orijinini buradan alırlar ve ileri devrelere kadar devam ederler. Ancak, glukozun da pirüvata kadar ayrışması bir tek basamakta olmayıp bir seri biyokimyasal reaksiyonları gerektirmektedir. Glukozun ayrışmasını gösteren bu basamaklar Embden-Meyerhof şemasında izlenebilir.
Embden - Meyerhof şeması yanda gösterilmektedir. | 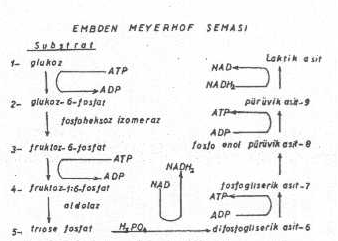
|
Oluşan pirüvik asit te, enzimler aracılığı ile, başlıca iki tarzda ayrışmaya tabi tutulur. Bu durum mikroorganizmaların aerobik veya anaerobik oluşlarına göre değiştiğinden, pirüvik asitin ayrışması da ya aerobik veya anaerobik olabilir.
1- Aerobik ayrışma: Pirüvik asitin oksijenin bulunduğu durumlarda Krebs trikarboksilik asit siklusu veya sitrik asit siklusu aracılığı ile, ve birçok reaksiyonlardan sonra, CO2 ve H2O 'ya kadar ayrışması olayına aerobik ayrışma adı verilir. Bu ayrışma, basamak basamak, aşağıdaki Krebs siklusu şemasında izlenebilir.
Pirüvik asitin aerobik ayrışması (Krebs siklusu) yandaki şekilde gösterilmektedir. | 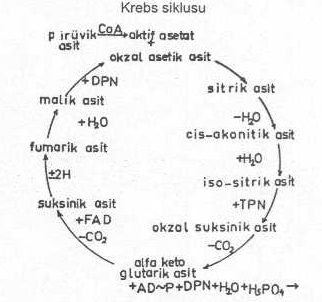
|
Bu şemanın özeti şöyledir:
2C3H4O3 + 502®6O2 + H2O®F° = 550 kcal.
Bir mol. glukozdan orijin alan 2 mol. pirüvat, karbondioksit veya suya kadar ayrışır ve 550 kcal enerji üretilir.
2- Anaerobik ayrışma (glikolizis): Glukozun oksijenin olmadığı durumlarda ayrışması sonu birçok ürünler meydana gelir. Enerjinin çoğu son ürünlerin atomları arasında muhafaza edildiğinden, fazla bir enerji üretilemez. Eğer, son hidrojen alıcısı olarak organik bileşikler
kullanılırsa o zaman fermentasyon olarak nitelendirilir. Diğer bir terimle, fermentasyon hem hidrojen vericinin ve hem de hidrojen alıcının organik olduğu biyokimyasal olaylardır.
Pirüvik asitin fermentasyon şeması yanda gösterilmektedir. | 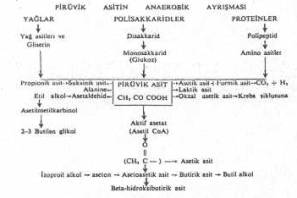
|
Bu şemaya göre önemli olan fermentasyon tipleri şöyledir:
1- Laktik asit fermentasyonu: Bu reaksiyon bakterilerde (streptokok, laktobasil, pediokok) DNP'e bağlı laktik dehidrogenase enzimi (pirüvat redüktase) tarafından katalize edilir ve tek basamaklı basit bir fermentasyondur. Bu reaksiyonda glukoz laktik asite ayrışır ve diğer elementler meydana gelmez (homolaktik fermentasyon).
Glukoz®2 pirüvat ® 2 laktik asit
2- Alkolik fermentasyon: Bu reaksiyonda, pirüvik asit önce asetaldehid ve CO2'e ve sonra asetaldehid de, etil alkole (etanol) redükte edilir. Birçok mikroorganizmalar (enterobakterler) ve mayalarda bu tarz fermentasyona rastlanır.
glukoz ® 2 pirüvat ® CO2 + asit aldehit ® 2 etil alkol
3- Propionik asit fermentasyonu: Birçok bakteriler (klostridium, propionibacterium, Vellonella, bazı Neisseria) tarafından pirüvik asit, propionik asite kadar redükte edilebilir.
glukoz® pirüvat ® oksal asetat ® suksinat® propionik asit
4- Butirik asit fermentasyonu: Klostridium sınıfına ait birçok mikroorganizmalar, basiller ve Butyricbacteriumlar glukozun fermentasyonu sonu butirik asit meydana getirirler.
glukoz ® pirüvat®aseto asetil-CoA+butril CoA ® butirik asit
5- Butilenglikol fermentasyonu: Enterobakter, Aeromonas, B. polymyxa ve diğer mikroorganizmalar glukozu 2,3-butilenglikola kadar ayrıştırabilirler.
glukoz ® pirüvat ® a-asetolaktat ® asetoin ® 2,3-butilenglikol
6- Karışık asit fermentasyonu: Enterobakterilerde (Escherichia, Salmonella, Shigella, Proteus) bu tarz fermentasyona rastlanır ve glukozun ayrışması sonu birçok ara maddeler (özellikle organik asitler) oluşurlar.
okzal asetat ® suksinik asit
formik asit ® CO2 + H2
glukoz + pirüvat ® asetik asit ® etil alkol
laktik asit
02.08. Karbonhidratların Sentezi
Polisakkaridlerin sentezi, monosakkaridlerden başlar. Dışardan hücreye giren veya hücre içinde bulunan monosakkaridler arasında glikozid bağının kurulması suretiyle polisakkaridler sentezlenirler. Bu sentez olayı bakterilerde başlıca iki tarzda yürütülür:
1- Fosforilasyon: Fosforilase enzimleri tarafından katalize edilen bu reaksiyonda monosakkarid üniteleri arasında glikozid bağı kurularak polisakkaridler sentezlenirler: Örn: N. meningitidis tarafından maltozun sentezi şöyledir.
beta-D-glukoz-1-P6+D-glukoz « beta-D-glukozil D-glukoz +P
(beta-maltoz)
Bu reaksiyonda maltoz fosforilase enzimi beta-bağlarının kurulmasını katalize eder.
Sakkarozun sentezi de şöyledir:
alfa-D-glukoz -1-P + D-fruktoz « sakkoroz +P
Bazı mikroorganizmalarda bulunan sukroz fosforilase enzimi, fosforilasyon olayını katalize ederek sakkaroz oluşumunu sağlar.
Eğer glukoz monomerleri devamlı olarak birbirleriyle birleşirse düz bir nişasta zinciri (alfa-1,4 -poliglikozid) meydana gelir. Glukojende ise zincir branşlıdır.
glukoz 1-fosfat + glukoz « nişasta + H3PO4
2- Transglikozilasyon: Bu reaksiyonda, glikozid bağının bir üniteden diğerine aktarılması ile, yeni bağlar kurulur ve polisakkaridler oluşturulur.
L. mesenteroides, bu biyokimyasal yolla, sakkarozdan bir polisakkarid olan dekstranı sentezler. Dekstran, glukoz monomerlerinden meydana gelmiştir.
n-sakkaroz(glukoz-1-fruktoz)®(dekstran)n+n-fruktoz
E. coli maltozdan nişasta benzeri madde sentezler.
n-maltoz (glukoz-1-glukoz)® (Dekstran)n + n-glukoz
B. megaterium, sakkarozdan bir polisakkarid olan levanın oluşturur.
n-sakkaroz (glukoz-1-fruktoz) ® (levan)n + n-glukoz
Hücre duvarı mukopeptidlerin sentezi: Gram pozitif ile Gram negatif bakterilerin hücre duvarları arasında farklar bulunmaktadır. Birincilerde çok az lipid bulunmasına karşın, Gram negatiflerde lipid miktarı daha fazladır. Fakat, her ikisinde de ortak olan bir çatı peptidoglikan (peptid zincirleri tarafından kovalent çapraz bağlarla birleştirilmiş olan paralel polisakkarid zincirleri) bulunur. Ancak, buna bağlanan ek komponentler arasında ayrılıklar vardır. Bakteri hücre duvarlarının sentezi başlıca 3 aşamada gerçekleşir.
1- Birinci dönemde, hücre içinde DP’ye bağlı olarak N-asetil muramil penta peptid sentezi (UDP -N- asetil muramil penta peptid) yapılır. Bu önemli madde, UDP (üridin difosfat) derivatifi halinde kendi prekürsorleri olan N-asetil glukozamin, fosfoenolpirüvat ve 5 amino asit ünitesinden sentezlenir. Birinci periyodun sonuna doğru, tekrarlanan şeker ünitelerinin tripeptid yan zincirlerine dipeptid D-alanil D-alanin bağlanır.
Birinci basamağı sentezi
N-asetil glukoz amin-1-fosfat
¯¬UTP
UDP-N-asetil glukozamin
¯¬fosfoenolpirüvat
UDP-N-asetil glukozamin 3-pirüvil eter.
¯¬NADPH
¯¬NADP
UDP-N-asetil muramik asit
L-alanin ®¯
L-glutamat ®¯
L-lysine ®¯
UDP-N-asetil muramil tripeptid
D-alanil-D-alanin ®¯
UDP-N-asetil muramil penta peptid
2- İkinci dönemde, biyokimyasal reaksiyonlar sitoplasmik membranda cereyan ederler. Birinci periyodda sentezi tamamlanan UDP -N-asetil muramil pentapeptid enzimatik olarak, UDP'den ayrılarak, membranda bulunan ve buna bağlı bir lipid intermedieri olan undekaprenil fosfata transfer edilir. Sonra bu bileşiğe, UDP-N-asetil glukoz amin ilave edilerek, peptidoglikan omurgasını tekrarlanan disakkaridleri oluşturulur. Bundan sonra da, bu disakkaridler peptid zinciri ile çapraz bağlanır. Bu zincirin uzunluğu ve amino asit kompozisyonu bakteriler arasında değişiktir. S. aureus 'da, bu zincir pentaglisindir.
UDP-N- asetil muramil pentapeptid
¯¬ undekaprenil fosfat
Undekaprenil fosfat-N-asetil muramil penta peptid
¯¬ UDP-N-asetil glukozamin
Undekaprenil fosfat-N-asetil muramil peptapeptid-B (4-1) -N-asetil glukozamin
¯¬ peptid yan zinciri
Undekaprenil fosfat-N-asetil muramil peptapeptid-B (4-1)-N-asetil glukozamin penta glisin
3- Üçüncü dönemde, transpeptidasyon reaksiyonu ile paralel peptidoglikan zincirleri arasında çapraz bağlantı kurulur ve çapraz bağlayan zincirin terminal glisin molekülü, bitişik peptidoglikan zincirinde bulunan N-asetil muramil penta peptid molekülünün penta peptid yan zincirinin ucundan D-alanini çıkarır ve böylece, birbirlerine çapraz bağlanmış disakkarid üniteleri peptidoglikan sentezlenmiş olur. Bu dönem sitoplasmik membran dışında cereyan eder.
Bazı Gram pozitif mikroorganizmalarda bu sağlam peptidoglikan çatı, teikoik asit tabakası ile kaplıdır. Buna karşılık, Gram negatif mikroorganizmaların bazılarında (E. coli) peptidoglikan, çatı kompleksi polimerik lipopolisakkaridle (LPS) örtülüdür.
Hücre duvarı polisakkaridlerinin sentezi: Gram negatif mikroorganizmalara antijenik özellik kazandıran tip spesifik polisakkaridlerin sentezi de, aynı mukopeptidlerin sentezlerine benzer.
Kapsül polimerlerinin sentezi: Desktran ve levanlar, disakkaridler (sakkaroz) kullanılarak sentezlenirler. Bu da ortamda sakkaroz ünitelerinin varlığına bağlıdır. Bakterilerde bulunan hyaluronik asit sentezi de benzer yollarla yapılır.
Hücre içi depo polisakkaridlerinin sentezi: Bazı hücreler içinde enerji ve karbon kaynağı olarak polisakkaridler (nişasta, glikojen) biriktirilir. Bunlar, gıda maddesi olarak, dış ortamdaki besin maddelerinin azaldığı durumlarda kullanılır.
03. Lipid Metabolizması
Lipidler, çeşitli bileşikler halinde, mikropların hücre duvarında (özellikle, Gram negatiflerde), sitoplasmik membranda ve gıda deposu olarak ta hücre içinde bulunurlar. Mikobakterilerde de hücre duvarında balmumu halinde ve çok fazla miktarda lipidlere rastlanılır. Lipidler genellikle, yağlar (yağ asitlerinin gliserin esterleri), balmumu (yağ asitlerinin monoalkol esterleri) ve kompleks lipidler (fosfolipid, lipopolisakkarid, lipoprotein, v.s.) halindedirler.
Lipidler, karbon (C) ve hidrojenden (H)oluşmuş organik bileşiklerdir. Yapılarında, ayrıca, fosfor (P), nitrogen (N) ve sülfür (S) bulunabilir.
03.01. Lipidlerin Ayrışması
Mikroorganizmalarda bulunan hidrolitik enzimlerden, lipaselar yağları esas komponentlerine ayrıştırır. Lipidler, hidrolize olunca, yağ asitleri ve gliserin meydana gelir.
lipase
Lipid + H2O---------àyağ asitleri + gliserin
Lipase
C3H5 (O.CO.R)3 + H2O---------àC3H5 (OH)3 + 3 R.COOH
03.02. Lipidlerin Sentezi
Mikroplarda lipidlerin sentezi, üredikleri ortamdaki karbon bileşiklerinin karakterine bağlıdır. Asetat, laktat ve glukoz içeren ortamlarda, Mycobacterium phlei ürediği zaman, kafi derecede lipid sentez ederek asido-rezistans hale gelmesine karşın, karbon kaynağı ihtiva etmeyen aynı besi yerinde, asido-rezistans karakter oluşmamaktadır.
Gliserin, genellikle, glukoza oranla lipid oluşturmada daha aktiftir. B. subtilis, glukoz ve maya ekstratı ihtiva eden ortamlarda, 6-branşlı zincir ile iki-düz zincirli yağ asitlerini sentez eder. Eğer besi yerine kısa zincirli yağ asitleri (propionik asit, butirik asit, v.s.) katılırsa uzun zincirli yağ asitleri sentezinde artma meydana gelir. Mikobakterilerde ve mayalarda, sature olmamış yağ asitlerinin sentezi, terminal elektron alıcısı olarak, moleküler oksijene bağlıdır.
Uzun zincirli yağ asitlerinin monomerik prekürsörleri Acetyl-CoA ile malonyl-CoA'dır. Malonyl-CoA, CO2 ve acetyl-CoA'dan biotin gerektiren reaksiyon sonucu meydana gelir. Yağ asitlerinin sentezi, genellikle, malonyl-CoA'dan başlar.
Mn++
CO2 + ATP + E -biotin « CO2 — E— biotin + ADP + Pi
CO2 — E — biotin + CH3.COSCoA ® E — biotin + HOOCCH2 COSCoA (malonyl — CoA)
Yağ asitlerinin sentezi, prekürsörlerden başlayarak bir seri reaksiyonlar sonunda gerçekleştirilir. Sentez için gerekli enerji ATP'den sağlanır. Önce acetyl-CoA, asetilasyona maruz kalarak malonyl-CoA meydana gelir. Bunu izleyen seri reaksiyonlardan sonra palmitik asit sentezlenebilir. Bu yağ asiti için net reaksiyon şöyledir:
Acetyl-CoA + 7 malonyl — CoA + 14 NADPH + 14H+ ® palmitik asit + 7CO2 + 8 CoA + 14 NADP + 67H2O
Bu reaksiyonda palmitik asit oluşuncaya kadar geçen birçok ara reaksiyonlar özel enzimler tarafından katalize edilirler.
Birçok bakteriler de, asetatları poli-beta hidroksibutirik asite çevirerek hücre içinde muhafaza ederler. Bazı mikroorganizmalar (mikobakteri, korinebakteri, nokardia) lipidleri, 30-90 karbon atomlu yağ asitleri halinde depolarlar.
Gram negatif bakterilerde bulunan lipopolisakkaridler ve Gram pozitif bakterilerdeki ribitol veya gliserol teikoik asit sentezleri yüzey makromolekül olması ve bu mikroorganizmaların antijenik özelliklerini tayin etmesi bakımından önem taşımaktadırlar. Enterobakterilerde lipid, merkez polisakkaride ve bu da tip spesifik olan ve O-antijenik özelliğini oluşturan polisakkaridlere bağlanmıştır. Bu lipid-A, glukoz amin + 3 deoxy-D-mannooctulosonic asit + yağ asitleri + fosfattan oluşmaktadır. Merkez polisakkaridde, etanol amin + fosfat + octulosonic asit + L-glycero-D-mannoheptose + glukoz + galaktoz + N-acetylglucoseamineden meydana gelmiştir. Antijen (O) zincirinin şekerleri serolojik tiplere göre değişir. S. typhimurim 'da şekerler abequose (3,6 -dideoxy-D-xylohexose), mannose, rhamnose ve galaktozdur. Lipopolisakkarid, bu mikroorganizmaların endotoksinlerinin esasını oluşturur.
Teikoik asit, ribitol veya gliserol ihtiva eden polimerdir. Teikoik asitlerin ekserisi, birbirine fosfodiester köprülerde bağlanmış polyolların tekrarlanan ünitelerinin oluşturduğu bir omurgadır. Genellikle, glukoz veya N-acetyglucose aminden meydana gelen şekerler, polyollere glikozid bağlarla birleşmişlerdir. D-alaninde aynı şekilde, polyollara ester bağları ile birleşmiştir. Polimer, ya hücre duvarına (ribitol veya gliserol polimerleri halinde) veya sitoplasmik membrana (gliserol polimerleri olarak) bağlanmıştır.
04. Protein Ve Amino Asit Metabolizması
Proteinler, kompleks organik bileşikler olup hücrelerin esas yapılarını oluştururlar. Proteinlerin bileşiminde, genellikle, karbon (C) %50, oksijen (O) %25 nitrogen (N) %16 ve hidrojen (H) %7 bulunur. Bazı proteinler de %1 kadar sülfür (S) ihtiva ederler. Bir kısmında da ayrıca, fosfor, demir, çinko ve bakır da bulunabilir. Hücrelerde, yapı ve görevleri bakımından çok çeşitli proteinler vardır. Proteinler yüksek moleküllü (5000-bir milyon) olduklarında kolloidal solüsyonlar meydana getirirler ve diyalize olmazlar. Fiziksel (ısı, UV-ışınları, X-ışınları, v.s.) ve kimyasal faktörler (asit, alkali, deterjan, ağır metaller ve bunların tuzları, vs.) proteinler üzerine olumsuz etki yaparlar. Proteolitik enzimlerle veya asit hidrolizasyonla, kendilerini oluşturan amino asitlere ayrışırlar. Proteinler, 20 tür amino asitin değişik sıralarda yan yana gelerek oluşturdukları polipeptidlerden meydana gelmiş polimerlerdir. Amino asitler birbirlerine kovalent olarak peptid bağları ile birleşmiştir. Bu peptid bağ, bir amino asitin karboksil ucundan suyun çıkması ile, diğer amino asitin a-amino grubu arasında kurulur. Polipeptid zincirinde yüzlerce amino asit vardır. Bazı proteinlerde bir ve diğerinde de birden fazla polipeptid zinciri bulunabilir. Her polipeptid zincirinin belli bir molekül ağırlığı, kimyasal yapısı, amino asitlerin sırası ve 3 boyutlu şekli vardır.
Proteinler yapılarına göre başlıca iki kısma ayrılabilirler. 1- Basit proteinler: Bu tür proteinlerden hidrolizasyon sonunda sadece amino asitler meydana gelir, diğer organik veya inorganik ürünler oluşmazlar. 2- Konjuge proteinler: Bunların hidrolizasyonu sonunda yalnız amino asitler değil, aynı zamanda organik ve inorganik komponentler de teşekkül eder. Proteinlerin amino asit olmayan kısmına prostetik grup adı verilir. Bu grubun kimyasal yapısına göre konjuge proteinler sınıflandırılabilirler (nukleoprotein, lipoprotein, fosfoprotein, flavoprotein, glikoprotein, v.s.).
Proteinlerin molekül ağırlıkları 5000'den (sığır insulini 5.700) bir milyon veya daha fazla (tütün mozaik virusu 40 milyon) olabilmektedir. Molekül ağırlıkları 36000'den fazla olanlar birden fazla polipeptid zincirine sahip olmaktadırlar. Örn. lizozimin (yumurta akında) molekül ağırlığı 13.900 olup bir tane polipeptid zincirinden oluşmasına karşın, E. coli 'deki tryptophan senthetase 159.000 M.A. da ve 4 polipeptidden, yine E. coli 'deki aspartat transkarbamilase, 310.000 M.A. ve 12 polipeptid zincirinden ve tütün mozaik virusuda (M.A. 40 milyon) 2130 polipeptid zincirinden meydana gelmiştir. Birçok bilinen küçük moleküllü proteinlerin (ribonuklease, sitokrom-c ve myoglobulin) 100 ile 300 amino asitten (12.000-36.000 M.A.) meydana geldiği saptanmıştır. Buna karşın, serum albümini yaklaşık olarak 550 ve miyosin de 1800 amino asitten oluşmaktadırlar.
Proteinlerin yapısı başlıca 4 karakter göstermektedir. Primer yapı: Polipeptid zincirindeki amino asitlerin türleri, sırası ve aralarındaki kovalent bağlanma, proteinin primer yapısını oluşturur. Sekonder yapı: Polipeptid zincirinin uzun eksen boyunca uzanması veya heliks oluşturmasıdır. Bu tür yapıya fibroz proteinlerde rastlanır. Tersiyer yapı: Polipeptid zincirlerinin kendi üzerine 3 boyutlu bükülerek sert ve sıkıca katlanmış yapı oluşturması durumudur. Kuaternar yapı: İkiden fazla polipeptid ihtiva eden proteinlerde, bu polipeptid zincirlerinin birbirleriyle birleşmeleri tarzıdır.
Proteinler, 60-70°C. ısıda veya maksimal pH limitlerinde, peptid zinciri omurgası dağılmadan, kendi özel katlanması açılabilir (denatürasyon). Bu durum proteinin biyolojik aktivitesinin kaybolmasına yol açar. Bazı hallerde de denatüre olan protein tekrar ilk katlanmış orijinal durumuna dönebilir (renatürasyon).
Proteinlerin yapı üniteleri olan amino asitlerde en az bir serbest amino (NH2) grup ile bir de serbest karboksil (COOH) grubu bulunur. Bu iki grup, amino asitler arasında fark göstermemesine karşın, R-grubunun kimyasal yapısı bir değişiklik yaratır. Aşağıda bir amino asitin açık formülü gösterilmiştir.
H NH2
| |
R — C — C — COOH
| |
H H
Amino asitler bu R grubunun özelliğine göre klasifiye edilmişlerdir. 1- Polar olmayan ve hidrofobik R-grubu, 2-Nötral polariteli R-grubu, 3-Pozitif yüklü R-grubu ve 4-Negatif yüklü R-grubu. Amino asitler, kendi adından türeyen 3 harfle sembolleştirilir. Örn. alanin (Ala), arginin (Arg), valine (Val), vs. gibi
Hücrelerde bulunan serbest amino asitler ya proteinlerin ayrışmasından, ya da hazır olarak dışardan sağlanırlar. Hücre sitoplasmasında aminoasitleri muhafaza eden ve depolayan "amino asit deposu" veya "havuzu" vardır. Polipeptid sentezi için gerekli amino asitler buradan temin edilirler. Amino asitler organik asitlerden türetilirler ve bu asitlerde hidrojen, alfa pozisyonda olup bunun yerini amin (NH2) almıştır.
04.01. Proteinlerin Ayrışması
Proteinler, amino asitlerin yan yana gelerek birbirleriyle birleşmesinden oluştukları için, bunlar arasındaki bağın çözülmesi, proteinlerin hidrolizasyonuna neden olur. Bu ayrışma işini, hidrolizan enzimler (proteinase) veya genellikle, asitler peptid bağına su ilave ederek yaparlar.
proteinase peptidase
Protein---------à polipeptid------------à aminoasitler
+H2O H2O
Proteinase ve peptidaseler genellikle ekstrasellüler enzimler olup hücre dışındaki büyük moleküle sahip proteinleri hidrolize ederek küçük ünitelere (amino asitlere) ayrıştırırlar. Amino asitler hücre duvarından ve sitoplasmik membrandan içeri girebilirler. Bunlar hücre içinde ya amino asit deposunda muhafaza edilir veya daha ileri aşamalara kadar hidrolize edilirler.
04.02. Amino Asitlerin Hidrolizasyonu
Mikroorganizmalar aminoasitleri başlıca 3 şekilde hidrolize ederler:
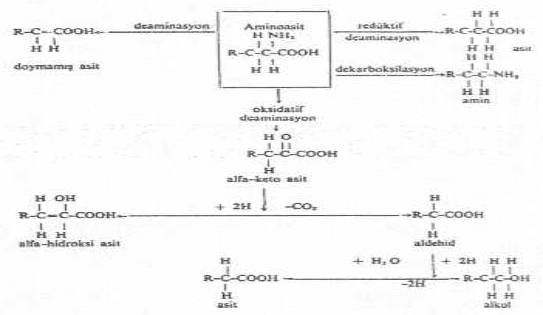
1- Deaminasyon: Bu tür amino asit hidrolizasyonu, bunlardan amin (NH2) grubunun çıkması sonu meydana gelir. E. coli 'ler, glutamik asiti, oksidatif deaminasyonla, amonyak ve keto asite çevirir veya redüktif deaminasyonla NH2 çıkarılarak, amino asit ayrıştırılır.
Oksidatif deaminasyon
aminoasit
amino asit + O2---------àketo asiti + amonyak
oksidase
Redüktif deaminasyon
amino asit + 2 H ---------à organik asit + amonyak
Redüktif deaminasyona E. coli ve M. phlei 'de rastlanmıştır.
2- Dekarboksilasyon: Amino asitler, bunlardan karboksil (COOH) grubunun çıkarılması sonu ayrışırlar. Bu olayı karboksilase enzimleri katalize ederler ve reaksiyonun sonunda karbondioksit ve amin meydana gelir.
R.CH.NH2.COOH ---------àR.CH2.NH2 + CO2
E. coli 'ler bu tarzda da amino asitleri ayrıştırabilir. Mikroorganizmalar özellikle asit karakterli ortamlarda üretildikleri zaman, amino asitler dekarboksilasyonla ayrışarak amin ve karbondioksit meydana gelir. Aminin oluşumu besi yerinin pH'sının yükselmesine neden teşkil eder. Deaminasyon daha ziyade alkali ortamlarda görülür.
3- Transaminasyon: Bu reaksiyonda, alfa-amino asitlerdeki amin grubu, alfa keto asite transfer edilir. Olay, transaminazlar tarafından katalize edilir. E. coli 'de transaminasyonla amino asit ayrıştırılmasına rastlanmıştır.
04.03. Amino Asitlerin Sentezi
Amino asitlerin sentezi, organik asitlerden orijinini alırlar. Örn. bütün alifatik amino asitler sadece 4 ara maddeden (pirüvat, 3-fosfogliserat, okzalasetat, alfa-ketoglutamat) sentezlenebilirler. Amino asitlerin sentezi başlıca 3 yolla meydana getirebilir:
1- Deaminasyon: Amino asitlerin bu tarzdaki sentezinde amonyak (HN3) önemli görev yapar ve sentez için NH2 ‘ye çevrilir. Sonra, amin grubu, organik asitin hidrojeni yerine geçerek, amino asit oluşturulur.
amonyak + fumarik asit «aspartik asit
2- Transaminasyon: Bir amino asitteki amino grubu, diğer keto asitine nakledilerek yeni amino asitler sentezlenirler.
alanin -- NH2 + alfa-ketoglutarik asit ® glutamik asit + pirüvik asit
3- Basamaklı sentez: Bazı amino asitler de küçük moleküllerden kademeli olarak sentez edilirler.
antranilik asit ®indol + serine ® triptofan
04.04. Peptidlerin Sentezi
Amino asitler oluştuktan sonra bunlar arasında peptid bağları kurulmak suretiyle peptidler ve bunlar da birleşerek polipeptidleri meydana getirirler.
05. Nukleik Asitlerin Metabolizması
05.01. Nukleik Asitlerin Sentezi
Pürin nukleotidler: Bakteriler tarafından pürin nukleotidlerin sentezi birkaç yoldan sağlanır.
Pürin nukleotidlerin genel sentez mekanizması inosinik asit oluşumundan başlar. Bu asit sonradan adenin ve guanin ribonukleotidlere çevrilir. Pürin ribonukleotidler de redükte olarak deoksiribonukleotidleri meydana getirirler.
Bundan sonra pürin ribonukleotidler ve deoksiribonukleotidler fosforilasyon reaksiyonuna tabi tutulurlar.
Bu tarz pürin nukleotidlerin oluşturulması yanı sıra ikinci bir sentezleme yolu daha bulunmaktadır. Bu yolda, hücre içi depolarda bulunan serbest bazlar ve nukleotidlerden yararlanılır. Bunlar, kendilerine tekabül eden nukleotidlere çevrilirler.
Pirimidin nukleotidler: Pirimidin nukleotidlerin sentezi, genellikle uridin-5-fosfattan orijin alır. Bu önemli madde, bakteriler tarafından sitidin ve timidin nukleotidlere çevrilir. Bunlar redükte olarak, deoksiribonukleotidler oluşturulur. Böylece pürin ve primidin ribonukleotidler meydana getirilir. Sonra, protein sentezinde bildirilen mekanizma ile DNA'nın biyosentezi gerçekleştirilir.
Bakteri hücrelerinde DNA'nın sentezi için şu maddelere gereksinme duyulur.
1. Dört adet deoksiribonukleotid trifosfat (d APPP, d GPPP, d CPPP, d TPPP). Burada PP'ler- pirofosfat, P-fosforik asit ve d'de-deoksiribozu ifade eder.
2. DNA polimerase enzimi,
3. DNA kalıbı,
4. DNA primer
5. Mg++ iyonları
DNA'nın sentezi için DNA polimerase enzimi, DNA kalıbını örnek alarak ve DNA primer uçlardan başlayarak, deoksiribonukleotid trifosfatları fosfodiester bağlarıyla birbirine bağlar (polimerizasyon).
Ribonukleik asitin sentezi için lüzumlu olan önemli maddeler de şunlardır:
1. Dört adet ribonukleotid trifosfat (r APPP, r GPPP, r CPPP, r UPPP). Burada r-riboz, P-fosforik asit, PP- pirofosfatlar.
2. RNA polimerase,
3. DNA kalıbı
4. Mg++ iyonları.
RNA'nın sentezinde RNA polimerase enzimi görev yapar.
05.02. Nukleik Asitlerin Ayrışması
Deoksiribonukleik asitin ayrışması: DNA'nın ayrışması DNase aracılığı ile yapılır.
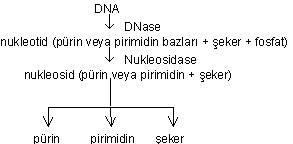
Oluşan ürünler de daha ileri devrelere kadar ayrışarak organik asitler, üre, karbondioksit ve diğer son ürünler meydana gelir.
Ribonukleik asitin ayrışması: RNA'nın ayrışması da RNase tarafından yönetilir. Ayrışma DNA'nınkine benzer bir tarz gösterir.
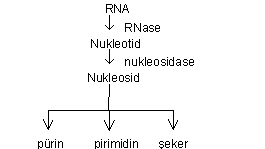
Bu maddeler de son ürünlere kadar ayrışırlar.
06. Enerji Metabolizması
Mikroorganizmalarda, enerji oluşturan oksidatif nitelikteki biyokimyasal olaylara biyolojik oksidasyon (biyooksidasyon) adı verilir. Oksidasyon, bir substratın oksijenle (O2) birleşmesi veya substrattan, hidrojen (H+) ve elektronun (e-) çıkması olayıdır. Bir madde okside olurken diğeri redükte olur. Bu nedenle de biyooksidasyon bir oksidasyon-redüksiyon reaksiyonudur. Biyooksidasyon birbirini izler ve birlikte oluşurlar. Bir maddeden, hidrojen ve elektronun çıkması için, bir hidrojen alıcısına gereksinme duyulur. Hidrojen veren substrat okside olur ve alıcı da, hidrojen ve elektronla birleşerek, redükte olur. Bu sebeple de elektron veren redüksiyon yapan, ve elektron alan da oksidasyon yapan ajandır.
H2 « 2H+ + 2e- veya H+ « H+ + e-
İnorganik maddelerin oksidasyonu için örnek:
H2S — 2(H+ e-) + 1/2 O2 ® S + H2O
Organik maddelerin oksidasyonu için örnek:
Etil alkol — 2 (H+ e-) ® asetaldehid + H2O
Bu iki reaksiyonda da oksijen, hidrojen ve elektron alıcısı olarak kullanılmıştır. Oksidasyon olayları sonunda genellikle enerji açığa çıkar.
Biyooksidasyon başlıca iki tarzda oluşmaktadır:
1- Aerobik oksidasyon: İnorganik ve organik substratların, okside olarak moleküler oksijenle (O2) birleşmesi bir aerobik biyooksidasyon olayıdır. Bu reaksiyon oksidase enzimleri aracılığı ile yürütülür. Aerobik oksidasyonda, tam bir oksidasyon meydana gelirse, açığa çıkan enerji çok fazla olur. Bu tarz biyooksidasyon, kemolitotrofik mikroplarda, toprak bakterilerinde, aerobik ve bazı fakültatif mikroorganizmalarda da görülebilir.
İnorganik maddelerin oksidasyonu (oksijenin hidrojen alıcısı olarak kullanıldığı olaylar):
H2 + 1/2 O2 ® H2O + enerji
NaNO2 + 1/2 O2 ® NaNO3 + enerji
2 S + 2 H2O + 3 O2 ® 2 H2SO4 + enerji
Organik maddelerin oksidasyonu:
C6 H12 O6 + 6 O2 ® 6 CO2 + 6 H2O +688 Kcal
Saccharomyces cerevisiae glukozu tam olarak okside eder ve 688 Kcal. açığa çıkar. Bu tarz aerobik oksidasyonda oksijen kullanıldığı ve tam bir ayrışma meydana geldiği için çok fazla enerji üretilmektedir. Ara maddelerin olmaması veya çok az olması, çıkan enerjinin miktarı ile ilişkilidir.
Bazı oksidasyon olaylarında da oksijen kullanılmasına karşın, tam bir oksidasyon meydana gelmeyebilir. Reaksiyon sonu oluşan ara ürünlerin atomları arasında bağlı olarak kalan enerjinin ancak bir kısmı açığa çıkar. Geri kalan kısmı ise bağlı kalır.
Acetobacterlerin şaraptan sirke asiti oluşturması buna örnek olarak verilebilir.
C2H5OH + O2 ® CH3.COH + H2O + 118 Kcal
asetik asit
Bu olayda, enerjinin çoğu asetik asitin atomları arasında bağlı kalmış, açığa çıkmamıştır. Birçok mantarlar da asetik asiti tam okside ederek CO2 ve H2O meydana getirirler ve fazla enerji açığa çıkarırlar.
CH3.COOH ® 2 CO2 + 2 H2O +ENERJİ
2- Anaerobik oksidasyon: Bu tür biyooksidasyon, fakültatif ve anaerobik mikroorganizmalar tarafından meydana getirilir. Anaerobik oksidasyonda, aerobikin aksine, hidrojen alıcısı olarak, oksijenin dışında, bir substrat kullanılır. Bu amaç için, inorganik (N, SO4, S, C, KNO3, NaNO3, CO2, CO vs) ve organik maddelerden yararlanılır (fermentasyon veya glikolizis).
Fermentasyon, anaerobik koşullarda, biyooksidasyon olaylarında, organik substratların hidrojen alıcısı olarak kullanılmasıdır. Anaerobik mikroorganizmalar hidrojen alıcısı olarak, oksijenden başka maddeler (inorganik veya organik) kullanırlar. Fakültatiflerde ise enzimler, hem aerobik ve hem de anaerobik koşullarda oksidasyon yapabilecek yetenektedirler.
CH3.COOH + SO4 ® 2 CO2 + H2S + 2 H2O
C6H12O6 + 12 KNO3 ® 6 CO2 + 6 H2O + 12 KNO3 + 429 Kcal
C6H12O6 ® 2 CO2 + 2 C2H5OH + 54 Kcal.
Aerobik, fakültatif ve anaerobik mikroorganizmalar oksidasyon durumunu gösterir toplu tablo
Glikolizis (fermentasyon) olayına örnek olarak, genellikle, glukozun ayrışması gösterilir. Bu önemli karbonhidrat, aerobik ve anaerobik ayrıştığına göre, oluşan ürünler de değişik olur. Bu nedenle de fermentasyon ürünleri, substrat ve organizmaya bağlıdır.
Mikroorganizmalarda enerjinin çok önemli görevleri vardır. Biyokimyasal olaylar ancak enerji yardımı ile gerçekleştirilebilir. Bu enerji, ya ışıktan ya da kimyasal maddelerin (inorganik veya organik substratlar) biyooksidasyonundan sağlanır. Enerjiye en fazla sentez olaylarında gereksinme duyulur. Diğer fonksiyonlar da (hareket, hücre bölünmesi, aktif transport, bioluminesens, vs.) yine enerji yardımıyla oluşturulurlar. Biyooksidasyon reaksiyonları sonu açığa çıkan enerji, elektrostatik kuvvetle, ADP (adenozin difosfat) ve ATP'nin (adenozin trifosfat) fosfat bağları arasında muhafaza edilir.
AMP, ADP ve ATP yandaki şekilde gösterilmektedir. | 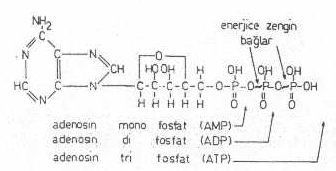
|
Böyle bağlara, enerjice zengin fosfat bağları adı verilir. Sentez olaylarında lüzumlu olan enerji, bu bağların hidrolize olması sonu meydana çıkan enerjiden sağlanır. Bu nedenle, ADP ve ATP, enerjiyi depo eden ve lüzumu halinde bunu gerekli yerlere yönelten bir merkez olarak görev yaparlar. Enerjinin depolanması ve kullanılması, hücrenin genetik kontrol sistemi altındadır.
Bakterilerde oluşan enerji ısı şekline dönüştürülemez. Aerobik oksidasyondan elde edilen enerji anaerobik oksidasyondan çok daha fazladır. Örn. glukozun aerobik oksidasyonunda 688 Kcal. ve 38 mol ATP elde edilmesine karşın anaerobik oksidasyonda sadece 54 Kcal. ve 2 mol ATP meydana gelir.
I. C6H12O6 + 6 O2 ® 6 CO2 + 6 H2O + 688 Kcal
II. C6H12O6 ® 2 CO2 + 2 C2H5OH + 54 Kcal.
İkinci reaksiyonda, glukozun anaerobik ayrışmasında, enerjinin çoğu oluşan ürünlerin atomları arasında saklı kalmıştır. Açığa çıkan enerji kimyasal bir enerjidir, kademeli ve kontrollü olarak meydana gelir.
Enerjice zengin bağlar: Substratların biyooksidasyonundan açığa çıkan enerji, özel ve hidrolize olabilir enerjice zengin bağlar tarafından tutulurlar. Bu bağlar ADP ve ATP'nin fosfat atomları arasında saklı kalır ve bu bağlar hidrolize olunca enerji serbest kalır. ADP'de bir ve ATP'de ise iki adet böyle bağ bulunur. ATP hidrolize olunca AMP veya ADP haline dönüşür. Bunların tekrar, ATP haline gelebilmesi için bir seri reaksiyonlara (oksidatif fosforilasyon, substrat fosforilasyonu ve fotofosforilasyon) gereksinme duyulur. Bu reaksiyonlar ATP oluşturan çok önemli biyokimyasal olaylardır.
1- Oksidatif fosforilasyon: Substrattan, hidrojen ve elektron çıkarılarak, moleküler oksijene kadar aktarılmasında, birçok ara maddelerden (flavoprotein, sitokrom, NAD, NADH2) geçirilir. Elektron aktarımı, bu işlemler sırasında, ADP'nin fosforilasyonu ile birlikte gerçekleştirilir.
2- Substrat fosforilasyonu: Bu tür fosforilasyon, Embden-Meyerhof biyokimyasal yolunda enerjice zengin bağların meydana gelmesi ile ilişkilidir ve genellikle, ADP ve ATP üretilir. Örn.3-fosfogliserolaldehid, Pi bulunan ortamlarda, NAD tarafından oksitlenerek, 1,3-difosfogliserik asit meydana gelir ve yeni fosfat grubu da ADP'ye aktarılır.
Hücrelerde, ADP ve ATP'den ayrı olarak, enerji içeren substanslar da bulunur. Bunlar arasında, sitozin trifosfat (CTP), guanozin trifosfat (GTP) ve uridin trifosfat (UTP) sayılabilir. Ancak, bunlar da enerjilerini ATP'den temin ederler ve çeşitli reaksiyonlara kanalize ederler.
06.01. Elektron Transportu
Substrat moleküllerinden, dehidrogenasyon yolu ile çıkarılan hidrojen ve elektron, diğer hidrojen alıcılarına özel taşıyıcı sistemlerin (elektron transport sistemleri) katalize ettiği reaksiyonlar aracılığı ile aktarılır. En iyi elektron taşıyıcı koenzimler arasında, NAD, NADP, riboflavinfosfat, FAD, çeşitli porfirinler bulunur. Substrattan, önce, NAD ile alınan hidrojen ve elektron, FAD'ye aktarılır. Buradan sitokrom oksidazlara geçerek havanın serbest oksijeni ile birleştirilir. Reaksiyonun sonunda H2O2 veya H2O meydana gelir. Substrattan ilk hidrojeni alan dehidrogenase ve en son alan da oksijendir.
(redükte) (redükte)
Substrat-2 (H+e) ®DPN (NAD) ®DPNH2 ®FAD ®FADH2®sitokrom-b ®sitokrom-c ®sitokrom-a ®202 +2H+® H2O
Reaksiyonda, hidrojen alan DPN, DPNH2 redükte olmuş forma ve bundan da hidrojeni alan FAD redükte olarak FADH2 şekline dönüşür. Bunlar da hidrojeni verdikçe ilk formlarını alırlar.
NAD (nikotinamid adenin dinukleotid): Dehidrogenasyon, reaksiyonu birçok hücrede genellikle, NAD veya NADP tarafından başlatılır. Bu koenzimler, önceleri, DPN (difosfo piridin nukleotid) ve TPN (trifosfo piridin nukleotid) olarak tanınırlardı. Bunlar, birçok apoenzimle birleşerek, esas aktif enzimin , özel substrat için, spesifitesini artırırlar. NAD'nin esas kısmını nikotin amid grubu oluşturur. Bu grubun piridin halkası, substrattan, hidrojen ve elektron alarak, NADH2 haline redükte olur. Bu da sonradan, ikinci hidrojen alıcıya (FAD) hidrojeni vererek NAD ilk durumuna reokside olur.
FAD (flavin adenin dinukleotid): Sarı renkli ve bir koenzim olan FAD'nin bileşiminde vitamin -B2 (riboflavin) bulunur. FAD hidrojen alınca FADH2'ye redükte olur. Bu sonradan hidrojen vererek FAD haline reokside olur. Hidrojen, FADH2'den sitokrom sisteminin demir içeren pigmentine (sitokrom-b) aktarılır.
DPN’in kimyasal yapısı yandaki şekilde gösterilmiştir. | 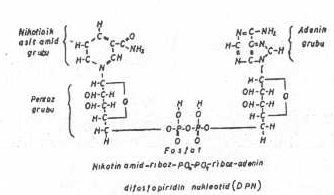
|
Sitokrom sistemi: Bu gruba ait sarı renkli pigmentler (a, a3, b,c, ve diğerleri) aerobik ve fakültatif mikroorganizmalarda bulunur. Sitokrom pigmentlerinde demir vardır. Sitokromlar hidrojeni aldıktan sonra iyonize ederler (H2 ®2H+ 2e-). Buradan çıkan hidrojen hücre dışına aktarılarak serbest oksijenle birleşir (H2O veya H2O2) ve elektron da sitokrom sistemine girer.
Eğer serbest oksijen yoksa veya bakteri bunu kullanamazsa, bu takdirde, hidrojen alıcısı olarak oksijen içeren substanslar (NaNO3, H2SO4, CO2 v.s.) veya diğer bileşikler (H2S, sülfit, vs.) kullanılır. Böyle mikroorganizmalara, oksijene gereksinme yönünden, fakültatif adı verilir.
Bioluminesens: Fluoresens mikroorganizmalar tarafından ışık oluşturulması olayına bioluminesens adı verilir. Olay, biyooksidasyon reaksiyonlarında oluşan enerjinin ışık enerjisi haline dönüştürülmesidir. Pseudomonas ve vibrio türlerinde böyle ışık verebilen mikroplara rastlanır. Meydana gelen ışık mavi-yeşil olup dalga boyu 490 nm civarındadır. Işınımlar bakteri ve mantarlarda devamlıdır. Mantarların ışığının dalga boyu 530 nm olup sarı-yeşildir. Bioluminesens olayında, serbest bulunan FMN (flavin mono nukleotid), NADH2 tarafından redükte edilerek enzimle (luciferase) birleşmesi sağlanır. Oluşan kompleks oksijenle okside olarak ışık vermeğe başlar. Işık fotonlarının çıkması ile, luciferase enzimini tekrar eski formuna dönüşür. Bioluminesens olayında uzun zincirli aldehitlerin (palmitil aldehit) önemi fazladır. Bu madde olmazsa, ışık çıkışı 1000 defa azalır.
uzun zincirli
aldehit
FMNH2+enzim®FMNH2 enzim®enzim +FMN ® enzim + foton
07.Metabolizma Regulasyonu
07.01. Genel Bilgiler
Mikroorganizmaların yaşamaları ve üremeleri için beslenmeleri gereklidir. Mikroplar,çevrelerindeki gıdaları, kendileri tarafından sentezlenen ve çeşitli etkilere sahip olan enzimleri yardımı ile yaralanabilecek duruma getirirler. Bu nedenle,enzimlerin aktivitesi mikroorganizmaların hayatları için zorunludur. Ancak, bunların da zamanında ve yeterince sentezlenmeleri ve koordine bir şekilde görev yapmaları önemlidir. Bu işlem bir regulasyon veya kontrollerle gerçekleştirilir. Enzim sistemlerinin sentezlenmeleri yönünden kontrolleri canlıların en önemli bir özelliğini oluşturmakla ve değişen çevre koşullarına çok yakından bağımlı bulunmaktadır.
Enzimlerin sentezlenme hızı ve miktarı ortamdaki gıda maddelerinin miktarı ve çeşidi ile ilişkilidir. Çok gereksinme duyulan enzimler yeterince ve devamlı olarak sentezlenirler ve bu devamlılık özel mekanizmalar tarafından kontrol edilirler. Bir bakteri hücresindeki bütün proteinleri sentezlemek için sayıları 600/800 'e kadar değişebilen enzime ihtiyaç vardır. En fazla gereksinim duyulan enzimler arasında proteinleri, karbonhidratları ve nukleotidlerin ayrıştırılmasında görev alanlarla, hücre duvarı, sitoplasmik membran ve ribosomların sentezlerinde vazife gören enzimlerdir. E. coli hücresinde,20 tane amino asit sentezinde lüzumlu olan bütün enzimler bulunur. Eğer ortama amino asitler katılırsa,bakteri hücresi,bu amino asitleri sentez için, kendisi özel enzim yapma işine girişmez. Bu durum,amino asitlerin sentezlenme işinde görev alacak enzimlerin imalinde bir gerileme veya duraklama meydana getirir.
Fazla gereksinme duyularak her zaman sentezlenen enzimler, bakteri yapısının bir parçasını oluştururlar (yapısal enzimler).Bazıları da ortamda kendi sentezlerini uyaran özel substratlar (indüktörler) bulundukları zaman sentezlenirler (indüklenebilen enzimler).Bu maddeler ayrıştıktan veya bittikten sonra enzim sentezi de sona erer. Örn. E. coli 'deki laktozu ayrıştıran betagalaktosidase enzimi (M.A. 5x105) bu türdendir.
E. coli biyokimyasal olayları incelemede kullanılan çok uygun bir mikroorganizma olup, dubleks karakterindeki kromozomunda 3000'den fazla proteini şifreleyebilecek kodlara sahiptir. Proteinlerin sentezi DNA üzerinde yerleşmiş olan gen veya genler tarafından yönetilir. Normal koşullar altında, yaşam için gerekli olan enzimlerin sentezlerini yöneten genler görev yaparlar. Diğerleri ise, genellikle inaktif durumda bulunurlar. Bunlar hayat için her zaman lüzumlu olmayabilirler. Gerçekten de, kromozom üzerindeki bütün genler aktif olsaydı veya aynı anda görev yapmış olsalardı, hücre lüzumsuz ve çok sayıda enzim ve proteinlerle dolmuş olurdu. Besi yerlerindeki gıdaların ve çevresel koşulların değişmesi ile bazı genler aktive edilir, diğer bir kısmı da baskı altında tutulur. Hücre bu şekilde, kendini, değişen çevre koşullarına uydurur ve yaşamını sürdürür. Örn; E. coli gliserinli besi yerinde üretilirse, hücrede, bu substratın ayrışmasını katalize eden enzimlerde bir artma meydana gelir. Buna karşılık, diğer bir kısım enzimler ise minimal düzeyde tutulurlar. Aynı şekilde, E. coli karbon ve enerji kaynağı olarak laktozlu bir ortamda üretilirse, bu substratın ayrışmasında görev alan beta-galaktosidase enzimin (indüklenebilen enzim) sentezinde 1000 misli artma olur. Ortama katılan gliserin ve laktoz bir indüktör olup kendilerinin ayrışmasında görev alan enzimlerin sentezlerini uyarırlar. Ancak, bütün indüktörler her zaman substrat olmayabilirler: Örn, isopropylthiogalactosid (IPTG) iyi bir indüktör olmasına karşın substrat değildir. Aksine, phenyl-B-D galaktosid de bir substrat olup indüktör değildir.
Bakterilerde enzim regulasyonu, DNA'dan mRNA'nın sentezi (transkripsiyon) ile başlamaktadır. Bakterilerde mRNA kısa ömürlü olup transkripsiyon bitince enzim sentezi de durmaktadır. Buna karşın sentezlenen enzim molekülleri uzun ömürlüdürler. Ancak bu proteinler de, hücrenin büyüme, gelişme, bölünme ve diğer biyokimyasal aktivitesi sonu giderek azalır ve tükenirler.
07.02. Enzim indüksiyonu
Mikroorganizmaların büyük bir kısmı enerji ve karbon kaynağı olarak birçok organik maddelerden yararlanırlar. Bunlardan faydalanılabilmesi ve enzim sentezi otomasyonunu çalıştırabilmesi için ortamdan bir sinyal bekler ve bunu da indüktörler sağlarlar. Örn, E. coli besi yerleri içinde bulunsun veya bulunmasın, her zaman glukozu ayrıştıracak enzimleri sentezlemesine karşın, laktoz için böyle hazırlıklı değildir. Laktozu hemen metabolize edemez veya ayrıştıramaz. Aradan belli bir sürenin geçmesi gerekmektedir. Laktozlu bir ortamda üreyen bir bakteri (E. coli), buradan alınıp tekrar laktozlu bir ortama konursa, latent dönem oluşmaz ve bakteri laktozu hemen ayrıştırmaya başlar (aradan zaman geçmemiş ise). Glukoz ve laktozlu ortamlarda ayrı ayrı üretilmiş E. coli hücresindeki enzim miktarları yönünden yapılan incelemelerde, laktozlu besi yerinde üretilmişlerde daha fazla enzimin sentezlendiği saptanmıştır. Bu enzimler arasında, beta-galaktosidase (laktozun, glukoz ve galaktoza ayrışmasını katalize eden enzim) ve galaktosid permease (laktozun hücre duvarından içeri girmesine yardımcı olan taşıyıcı enzim) önemli miktarlara ulaşmaktadır. Bundan sonra, E.coli 'nin laktoz metabolizması ile ilgili diğer bir enzim gelmektedir (transasetilase). Beta-galaktosidase ile birlikte bu enzimlerin düzeyinde de bir artma olur. Beta-galaktosidase sentezi durursa diğerlerinin üretimleri de sona erer. Bu nedenle, bu üç enzim birbirleri ile çok yakın ilişkili olup, bunların sentezlerini idare eden genler DNA üzerinde birbirine bitişik olarak sıralanmışlardır. Bu üçlü gruba (üniteye) laktoz operon (lac-operon) adı verilir.
Bu enzimlerin sentezini, yapıca laktoza benzeyen suni indüktörler (thiomethylgalactosid ve isopropylthiogalactosid) kullanılarak da uyarmak mümkündür.
07.03. Lak-Operon Ve Regulator Genleri
Operon, kromozom üzerinde birbiriyle çok sıkı ilişkide bulunan gen topluluğunu (üniteyi) ifade eder. Bu genler birbirleriyle koordine (aktivasyon ve inaktivasyon) bir şekilde yönetilirler. En iyi bilinen veya incelenen operon, laktoz operondur. Bu genler grubu, laktoz metabolizmasını idare ve kontrol eder. Lak-operon, başlıca 3 tane strüktürel genden oluşmuştur (z, y, a) ve bunlar aynı zamanda polisistronik mRNA (lak-mRNA)'yı da meydana getirirler. Bu messenger RNA, beta galaktosidase (z), galaktosid permease (y) ve transasetilase (a)'yı şifreler. Lak-permease (galaktosid permease) laktozun hücreye girişine yardım eden bir taşıyıcı enzim olup bir üniteli proteinden oluşmuştur. Transasetilase ise 2 alt üniteli bir enzim olup, acetyl-CoA'dan bir acetyl grubun laktoza transferini katalize eder. Bu strüktürel genler, regulator sistem olarak iş gören 3 tane DNA segmenti tarafından kontrol edilir. Operonların çalışmasını operatör genler düzenlerler.
Lak-operonun durumu yandaki şekilde gösterilmektedir. | 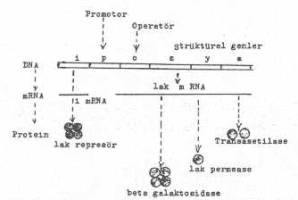
|
07.04. İ- Geni (Regulatör Gen) Ve Represör
Bakteri DNA'sında genlerin çalışmasını düzenleyen ve kontrol eden genler vardır. E.coli de, laktoz metabolizması veya diğer bir deyimle beta-galaktosidase için, lak-operonda bir regulatör gen (i-geni) bulunur. Bu gen, her biri 40.000 dalton olan 4 alt üniteden oluşmuş bir protein represörü (lak-represör) şifreler. Bir tetramer olan represör, DNA üzerindeki operatör bölgeye özel olarak ve kuvvetlice bağlanır. Represörler, proteinin sentezini baskılar veya engeller. Represörler de, DNA tarafından şifrelenmiştir. Represörlerin her zaman önleyici karakteri olmayabilir. Bunların da aktif ve inaktif olduğu durumlar vardır. Bu durumlar, indüktör ve korepresör (son ürünler, metabolitler) molekülleriyle ilişkilidirler. İnaktif represöre, bir korepresörün bağlanması bunu aktif hale getirir. Örn. amino asit bulunmayan bir besi yerinde üretilen E. coli kültürüne sonradan bu maddeler katılırsa, amino asit biyosentezi ile ilişkili enzim yapımını denetleyen aktif represör sayısında artma oluşur. Böylece, özel mRNA yapımı önlenmiş olur. Represörler birden fazla protein sentezini de denetleyebilirler. Örn. E. coli de, beta-galaktosidase represörü, bunun dışında iki enzimi (galaktosid permease ve transasetilase) daha denetler.
Represörün her bir alt ünitesinde, indüktör için birer bağlanma yerleri vardır. Lak-operon için doğal indüktör olan laktoz, hücreye ulaştıktan sonra bazı değişmelere uğrayarak represöre bağlanır. Buna karşın, yapay bir indüktör olan isopropylthiogalactosid (IPTG) fazla değişikliğe uğramadan represöre tutunabilir ve indüktör olarak görev yapabilir. IPTG'nin bağlanmasından sonra, represör konformasyonal bazı değişikliklere maruz kalarak operatöre bağlanması önlenir. Böylece de lak-operonun transkripsiyonu indüklenmiş olur.
İndüktör ve represörlerin çalışma mekanizması yandaki şekilde gösterilmektedir. | 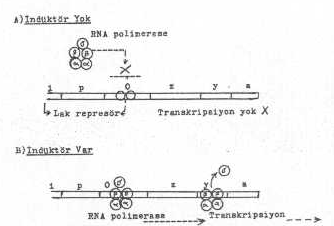
|
Şemanın izahı: I. durumda: İndüktörün yokluğunda lak-represör, operatöre sıkıca bağlanır ve strüktürel genin RNA polimerase tarafında transkripsiyonu önlenir. II. durumda, indüktör varsa (İP-TG) lak-represöre tutunur ve bunda konformasyonal değişiklikler oluşturarak operatöre bağlanmasına mani olur. Bunun sonunda serbest kalan polimerase, sütrüktürel genleri transkripte eder. E. coli de RNA polimerase 5 alt ünitelidir (F = sigma, 95.000 dalton, b/b1 = 160.000 ve 2 alfa, 40.000 dalton). Transkripsiyon başladıktan sonra, sigma ayrılır ve esas RNA polimerase DNA'ya bağlanmış olarak kalır.
E. coli hücresinde lak-operon için 10 tane represör molekül varsa da, lak-operonun laktozla temasında bin misli aktive olur ve oluşan beta-galaktosidase total proteinin %3'üne ulaşır. Bazı mutantlarda bu oran %15'e çıkabilir. Üremekte olan hücrelerde mRNA kalıp sayısı fazladır. Beta-galaktosidase sentezi sırasında, bu enzim için 30-50 kadar mRNA molekülü varken, enzim yapılmadığı zaman, bu oran bir veya birin altına inebilir.
07.05. Promotor (P)
Promotor bir DNA segmentidir. Bu segmente, sütrüktürel genlerinin transkripsiyonunda görev yapan ve bu olayı başlatan RNA polimerase bağlanır. Şemada da, operatöre bitişik olarak solda gösterilmiştir. Promotor, bir kilit regulatör elementidir. Çünkü, operonun mRNA sentez derecesini kontrol eder.
07.06. Operatör (O)
Bir DNA segmenti olan operatöre, represör bağlanır. Operatör, kendi kontrolü altında bulunan sütrüktürel genlerle çok sıkı bir ilişkisi vardır ve bunların yanı başında bulunur. Buna karşın regulatör gen (i-geni) ayrı bir yerde lokalize olmuştur. Şemada operatör gen, sütrüktürel genlerin (z, y, a) solunda gösterilmiştir. Bu duruma göre, promotora bağlanan RNA polimerase, sütrüktürel genleri transkripte etmeden önce ilk defa operatöre uğrar. Eğer, operatör represöre bağlanmış ise, RNA polimerase, sütrüktürel genleri transkripte edemez. Böylece, lak-operon; represör, promotor ve operatör üçlüsü tarafından kontrol altında tutulmuş olur.
Eğer, represör operatöre bağlanmış ise, RNA polimerase ilerleyerek sütrüktürel genleri transkripte eder. Bu işlem sonunda oluşan polisistronik mRNA, sistemdeki üç enzimi şifreleyerek beta-galaktosidase, galaktosid permease ve transasetilase sentezlenir ve laktoz metabolize olur. Lak-operatör, 12-15 nukleotidden oluştuğu saptanmıştır.
Jacob ve Monod modeli olan operon şeklindeki enzim regulasyon mekanizması (negatif kontrol sistemi), diğer substanslar için de geçerli olabileceği bildirilmektedir. Örn. triptofan operon aynı mekanizma ile izah edilebilmektedir. Bu yöntem histidin operon için de uygulanabilir.
Bunlarda da regulatör gen represör proteini oluşturmaktadır. İlk başta inaktif olan bu molekül, metabolitlerle (triptofan, korepresör) bağlandıktan sonra konformasyonal değişikliklere uğrar ve bu nedenle de operatörü bağlar ve triptofanın biyosentezi yolu ile ilişkili bütün operonun transkripsiyonuna mani olur.
Enzim sisteminin pozitif regulasyonu: Jacob ve Monod modeli enzim regulasyon mekanizması (operon sistemi) genellikle negatif bir kontrol sistemini ifade eder. Mikroorganizmalarda, bu tür mekanizmaların yanı sıra diğer bazı sistemlerin de varlığı ortaya konulmuştur. Bunlardan biri de pozitif regulasyon mekanizmasıdır. E. coli 'de L-arabinoz operon, hem negatif ve hem de pozitif sistemle kontrol edilir. Bu operonda, isomerase, kinase ve epimerase olmak üzere 3 adet sütrüktürel gen (ara-D, ara-A ve ara-B) bulunmaktadır.
Arabinoz operonunun genel çalışma şeması yandaki şekilde gösterilmektedir. | 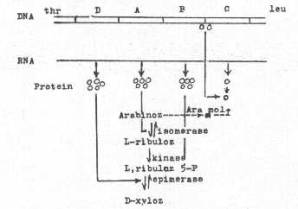
|
Ara -D, ara-A ve ara -B genleri sıra ile isomerase, kinase ve epimerase enzimlerini spesifiye ederler. C-geni biri operatöre bağlanan ve represör olarak iş gören bir proteini kodlar, diğeri de pozitif regulatör element olarak görev yapar ve regulatör gene (i-geni) bağlanır. Bu, i-bölgesi, promotorun analogu durumundadır. L-arabinoz operonda, C-geni 2 halde bulunur. Biri operatöre bağlanarak baskılama işlemi yapar, diğeri ise i-genine bağlanarak, genin aktivasyonu sağlar ve böylece pozitif regulatör olarak iş görülür.
L-arabinoz dışında, E. coli 'de maltoz ve ramnose metabolizmasında pozitif kontrol sistemin rol oynadığı da bildirilmektedir.
07.07. Katabolik Represyon
Katabolik aktivitede görev alan birçok enzimler bazı represyonlara maruz kalabilirler. Bir bakteri, çabuk metabolize olabilen bir karbon ve enerji kaynağı içinde üretilirse hücrede artan bir ATP birikmesi meydana gelir ve enzimlerin represyonuna yol açar. Enzimlerin baskılanması, enerji kaynaklarının daha yavaş metabolize olmasına neden olur. E. coli, laktoz ve glukozlu ortamda üretilirse ilk önce glukoz metabolize olur ve bu nedenle de beta-galaktosidase sentezi azalır. Glukoz varken, laktoz, indüktör olarak pek iş göremez. Bakteri enzimleri tarafından kolayca metabolize olan diğer substanslar da aynı tarzda etkiler ve indüklenen enzimler üzerine baskılayıcı etki yaparlar. Bu baskılamayı kaldırmak için ortama 3,5-cyclic AMP'nin ilâvesi gereklidir. Bu madde birçok bakteri hücresinde bulunur ve katabolik enzimlerin sentezi için aktivatör olarak görev yapar. Glukozun çok çabuk ayrışması hücrede ATP'nin fazla birikmesine ve cAMP'nin azalmasına yol açar. Bu da katabolik represör olarak çalışır. Örn. P. putida, glukozlu ortamda suksinat içinde olduğundan, daha yavaş ürer. Suksinat glukozdan daha etkili represördür.
Katabolik represyonun mekanizması represör-operatör tip kontrol sisteminden farklıdır. Katabolik represyona, intrasellüler cAMP'ın azalması yol açmaktadır.
Siklik AMP'nin intrasellüler düzeyi, adenilase tarafından düzenlenir. Bu madde, nukleotidleri ve fosfodiesterazı sentez eder. Fosfodiesterase ihtiva etmeyen mutantlarda cAMP yüksek düzeydedir.
Siklik AMP, operonun aktive ve deaktive edilmesinde önemli role sahiptir. Her biri 45.000 dalton molekül ağırlığında iki alt birime sahip olan protein karakterindeki cAMP, siklik represörle birleşerek bir kompleks (CR-cAMP) oluşturur ve promotora bağlanarak, RNA polimerazın bu bölgeyi tanımasını kolaylaştırır.
07.08. Son Ürün İnhibisyonu (Feedback inhibisyon)
Reaksiyonları katalize eden ilk enzimlerin, metabolik yollarda oluşan son ürünler tarafından baskılanması ve sentez olayının durması, enzim regulasyon mekanizmasının diğer önemli bir türüdür. Buna enzim sentezinin represyonu da denebilir. Örn. E. coli 'de, triptofan sentetase enzimi, triptofan ve bazı analogları tarafından inhibe edilerek aktivitesine son verilir. Histidin ve leusin sentezleri de aynı mekanizma ile regule edilirler. Ortamdaki son ürünler, herhangi bir şekilde, diğer biyosentetik reaksiyonlarda kullanılmazsa, hücre içi miktarı azalır ve sentez olayları durur. Eğer sarf edilirse, sentez yine başlar. Bu baskılama genetik bir karakter taşımaz. Mutasyonlarla değiştirilebilir ve baskılama işlemi kaldırılabilir.
Son ürün inhibisyonu, birçok şekilde meydana gelebilir. Lisin ve metionin sentezi ile aspartik asitten treoninin sentezi buna örnek olarak verilebilir. Bu biyokimyasal yolda, ilk enzimatik reaksiyon, aspartokinase tarafından katalize edilir. Bu enzim, bildirilen 3 son üründen (lisin, metionin ve treonin) biri tarafından inhibe edilerek sentez durdurulur. Bazı mikroorganizmalarda, bu işi 2 son ürün birlikte yapabilir (multivalent inhibisyon). İndüktöre maruz kalan hücrelerde sentez edilen enzimin maksimal bir düzeye ulaşabilmesi ve aynı şekilde represyonun da tam etkileyebilmesi için birkaç neslin geçmesi gereklidir.
07.09. Allosterik Proteinler
Birçok enzimler, substrat olmayan bileşikler tarafından inhibe edilirler. Bunların yapıları, substrata sterik bir benzerlik (isosterik) gösterirler. Buna malonik asit ve suksinik arasındaki kompetatif inhibisyon, örnek olarak verilebilir. Ancak, bazı düşük moleküllü bileşikler de, enzimle sterik benzerliği olmamasına (allosterik) rağmen allosterik enzimlerini inhibe veya aktive edebilirler. Buna E. coli ’de ki aspartat transkarbamilase örnek olarak gösterilebilir. Bu enzim, pirimidin biyosentez sırasının ilk enzimi olup bunun için substrat, karbamil fosfat ve aspartattır. Fakat, enzim, allosterik olarak sitidin trifosfat tarafından inhibe edilir. Bu sitidin trifosfat, spesifik biyosentetik sıranın son ürünüdür.
Yukarıdakine benzer bir örnek de glutamik dehidrogenase allosterik proteinidir. Bunun aktivitesi küçük moleküller veya steroidler tarafından inhibe edilir. Böylece enzim aktivitesi kontrol altına alınır.
07.10. Enerji Kontrolü
Hücre içinde enzim sentezinin regulasyonunda enerji kontrolünün önemi fazladır. Gıda maddelerinin ayrışmasından meydana çıkan enerji, enerjice zengin fosfat bağları arasında muhafaza edilirler. Böyle bağlara sahip olan ADP ve ATP, kendilerinde bulunan bu enerjiyi sentez olaylarında kullanır ve reaksiyonların seri halinde devamını sağlar. Eğer, biyosentez olayları için gerekli ve yeterince enerji temin edilemezse, hücreler kendilerine lüzumlu maddeleri yapamazlar. Bu maddeler arasında enzimler de vardır. ATP'de biriken enerji, kendisinin oluştuğu hızda, hemen sarf edilemez ve bağlar arasında kalır. ADP'deki rezerve bitince daha fazla enerji bağı oluşumu önlenir ve ATP'deki enerji sarf edilinceye kadar, enerji sağlanması da inhibe edilir.
07.11.Nukleik Asit Sentezlerinin Regulasyonu
Bakterilerde nukleik asit (DNA ve RNA) moleküllerinin sentezlerinde özel kontrol mekanizmaları görev yapmaktadır.
DNA sentez regulasyonu: Bakterilerde, DNA'nın replikasyonu sırasında iki iplikçiğin birbirinden tam olarak ayrılması türlere göre az çok değişiklik gösterir. Her ne kadar aynı tür içinde de bazı ufak ayrımlar olmasına karşın, replikasyon, genellikle, sabit bir karakter taşır. Örn. bir bakteride tüm DNA molekülünün baştan sona kadar ayrılabilmesi için 40 dakika geçtiği kabul edilirse, bu sürenin 40 dakikadan az olduğu durumlarda DNA sentezi hızlanmıştır. Ancak bu kısalan süre, DNA polimerazın polimerizasyon aktivitesi hızından daha az olamaz. Böyle durumlarda da birinci replikasyon çatalının dışında ve bunun ayrımı bitmeden, uçlarda ikinci ve üçüncü çatallar oluşabilir. Bu durum bölünme süresini kısaltır. Eğer 3 çatal oluşursa, bölünme süresi 20 dakikaya inebilir. DNA'nın replikasyonu 40 dakikadan fazla uzarsa, DNA sentezi de yavaşlar ve tek bir replikasyon çatalı meydana gelir.
RNA sentez regulasyonu: Mikroorganizmalarda bulunan DNA miktarı genellikle sabit bir durum arz etmesine karşın, ribosomal RNA (rRNA), üreme ortamının bileşimine göre azalabilir veya çoğalabilir. Az gıda içeren ortamlarda, bazı durumlarda, RNA sentezi çok azalır veya durabilir. Böyle hallerde hücre içindeki protein sentezlerinde de bir yavaşlama göze çarpar. Ribosomal RNA’ ların gereği kadar sentez edilememesi bunları,ribosomların mRNA üzerinde yeterince toplanamamasına yol açar. Bu da sentez mekanizmasına olumsuz yönde etkiler. Bazı koşullarda da serbest olarak bulunan ribosomlar, RNA sentezini kodlayan genler üzerinde baskılayıcı görev yaparak, rRNA sentezini regule edebilmektedirler.
[1] Kaynak: Temel Mikrobiyoloji