Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji1
01. Giriş
02. Materyallerin Toplanması
02.01. Kutan Mikozesler
02.02. Subkutan ve Sistemik Mikozesler
03. Materyallerin Muayenesi
03.01. Kutan Mikozeslerde
03.02. Subkutan ve Sistemik Mikozeslerde
04. Materyallerin Ekilmesi
04.01. Kutan Mikozesler
04.02. Subkutan ve Sistemik Mikozesler
01. Giriş
Mantar hastalıklarının (Mycoses) teşhisi, hastalık etkeninin patolojik materyallerde tespit edilmesi, kültürler yardımı ile üretilmesi, izolasyonu ve identifikasyonu, serolojik ve alerjik testlerle ile gerçekleştirilir. Buna, klinik semptomlar ve otopsi bulguları da (eğer çok nadiren ölüm olursa) büyük ölçüde yardımcı olur. Ancak, özellikle, laboratuvarlarda, buraya getirilen her türlü muayene materyallerini en iyi ve en uygun şekilde işleyecek ve değerlendirecek tecrübeli laboratuar elemanlarına gereksinim vardır. Patolojik materyallerden izolasyon şansının artırılmasında, hastalardan alınan materyallerin önemi çok fazla olmaktadır. Materyallerin seçimi, infeksiyonunun türü ve yerleştiği yere göre değişebilir.
Sistemik infeksiyonlardan şüpheli olgularda laboratuar elemanlarının çok daha dikkatli bulunması gereklidir. Özellikle, H. capsulatum, B. dermatitidis, C. immitis vb. bazı mantar hastalık etkenleri bulaşabilir ve sağaltımı çok zor infeksiyonlara yol açabilir. Bu mantarların sporlarının inhalasyonu ölümcül mikozeslere neden olabilir. Böyle durumlarda, laboratuvarlarda özel inokulasyon kabinetinin veya benzer kabinetin kullanılması şarttır. Bu infeksiyonlardan şüpheli olgulardan alınan marazi maddeler de, mutlaka, tüplere ekimleri yapılmalıdır ve ekim için petri kutusu sakıncalı olabilir. Tüplerde üremiş mantarlardan da, mümkün olduğu kadar, lâm kültürleri yapılmamalıdır. Bu tür mantarlarla çalışmalar veya laboratuarlarda izolasyonlar yapılacaksa, elemanların maske kullanması ve kültürlerin özel inokulasyon kabineti altında açılması ve sterilizasyon veya dezenfeksiyon kurallarına çok dikkat edilmesi gereklidir.
Dermatofitlerden ileri gelen hastalıklarda da, bunların bazı türlerinin, zoofilik-antropofilik karakterde olmaları nedeniyle, yine dikkatli bulunmak şarttır. Böyle materyallerle (deri ve tırnak kazıntısı, tüy, kıl, yün, deri parçası, vs.) direkt temas bulaşma ile son bulabilir. Bu nedenle, mantar hastalıkları teşhis ve araştırma laboratuarlarında, aynen bakteriyoloji veya viroloji laboratuvarlarında olduğu gibi, bazı kurallara uyulması lazımdır ve herhangi bir önlem almada kusur yapılmamalıdır.
02. Materyallerin Toplanması
Mantar hastalıklarının teşhisinde, muayene materyallerin alınması ve gönderilmesi en önemli ve dikkat edilmesi gereken noktalardan birini oluşturmaktadır. Patolojik maddeler, genellikle, herhangi bir sağaltım yapılmamış olanlardan ve yeteri miktarda alınır. Materyaller, ağzı vidalı kapalı şişelere veya petri kutularında toplanır. Alma işleminde kullanılan makas, pens, bistüri, küret, vb. malzeme ile şişe veya petri kutularının çok iyi sterilize edilmiş olmaları gereklidir. Nemli malzeme, saprofitik mantar sporlarının germinasyonunu kolaylaştırır. Alınan materyal en seri vasıta ile mikoloji laboratuarına gönderilir. Eğer, göndermede gecikme olacaksa, bu zaman materyal buzdolabında muhafaza edilebilir. Materyalle birlikte, gerekli bilgi içeren bir yazı da gönderilir.
02.01. Kutan Mikozesler
Kutan (süperfisial) mikozeslere genellikle dermatofitler (Microsporum, Trichophyton ve Epidermophyton cinslerine ait türler) neden olurlar.
Bu infeksiyonları teşhis için aşağıda bildirilen materyaller alınır :
Deri kazıntısı : Derideki lezyonların yeri, büyüklüğü, şekli, yayılma durumu ve oluşturduğu bozukluğun derecesi, vb. önemli noktalar iyice incelendikten sonra, lezyonlarda bulunan yabancı maddeleri, kontaminant mantar sporlarını ve diğer ajanları gidermek için, lezyonlar, %70 alkole batırılmış pamukla iyice silinirler. Alkol kuruduktan sonra, steril makas, pens, küret, bistüri, vs., ile lezyonların kenarlarındaki aktif bölgelerden deri kazıntısı alınarak steril kuru petri kutularına veya şişelere, yeteri miktarda toplanır ve ağzı iyice kapatılır. Eğer lezyonlar birden fazla ise, her lezyon için ayrı örnek alınır ve hemen laboratuvara gönderilir.
İnfiltrasyon olan bölgelerden veya ekzudatif karakterdeki lezyonlardan deri kazıntısı alırken kanatmamaya dikkat edilmelidir. Deri kazıntıları, genellikle, mantar izolasyonu için, kıllar kadar avantaja sahip değillerdir. Lezyonlar, herhangi bir kimyasal madde ile muamele edilmişse, bu taktirde, alkolle temizleme işlemini daha dikkatlice yapmalı ve alınan materyal steril su içinde 1-2 gün kadar bekletilmeli ve yıkanmalıdır. En iyisi, ilaç kullanmamış hastalardan veya lezyonlardan materyal alınmasının sağlanmasıdır.
Kıllar : Lezyonlu bölgenin kenarlarındaki tüyler, kıllar steril pensle tutularak özellikle kıl kökleri kıl follikülleri ile birlikte çıkarılarak, yeterli miktarda alınır. Lezyonların ortasında, genellikle, az sayıda mantar elementi bulunur ve bu bölgenin rengi de çeşitli nedenlerle değişebilir (dejenerasyon, parçalanma, mikrobial kontaminasyon, vs.). Kıl folliküllerinde fazla mantar elementi toplandığından materyali buralardan almak, izolasyon şansını artırır.
Eğer deride gözle iyice görülebilecek derecede lezyonlar yoksa veya latent infeksiyon varsa, böyle durumlarda steril diş veya saç fırçalarından yararlanılır. Deri bu malzeme ile, bir petri kutusuna iyice kazınarak hem kıl hem deri kazıntısı örnekleri alınır. Ancak, materyalin büyük bir kısmı fırçanın tüyleri arasında kalacağından, kültür için, fırça olduğu gibi hafifçe besi yerine de daldırılır.
Tırnaklar : Tırnakları iyice temizlendikten ve alkolle silindikten sonra, veya küretle kazınarak veya makasla kesilerek yeterince materyal alınır. Bazı durumlarda, tırnağın derin kısımlarından da madde toplanmalıdır.
02.02. Subkutan ve Sistemik Mikozesler
Subkutan mikozeslerden Rhinosporidiosisde, burundan gelen akıntılar ve burunda meydana gelen polip benzeri oluşumlardan; Sporotrichosisde de deride teşekkül eden ülserlerden akan irinler, lenf yumrusu içeriği ve diğer lezyonlardan alınan patolojik materyaller gönderilir. Bu marazi maddeler, mümkün olduğu kadar aseptik koşullarda ve usulüne göre alınırlar. Deride vesikül varsa, üzeri alkolle silindikten sonra, steril bir makasla üst kısımdan kesilerek açılır. İçindeki materyal kapiller veya normal bir pipetle çekilerek küçük bir tüpte toplanır. Materyalin çok az olduğu durumlarda, iki steril lâm arasına alınır ve bir kağıda sarılarak gönderilir.
Mantarlardan ileri gelen sistemik mikozeslere çok az sayıda rastlanır. Bu hastalıklarda alınacak materyal, infeksiyonun türüne ve yerleştiği yere göre değişebilir.
Aspergillosisde : Bu hastalık daha ziyade akciğerlerde lokalize olduğundan, bronşial sekretler ve biopsi materyalleri alınır.
Blastomycosisde : Bu infeksiyonda lezyonlu deri, lenf yumrusu içeriği, lezyonlardan akan irinler, bronşial sekretler ve biopsi materyalleri,
Candidiasisde : Lezyonlu doku ve organ parçaları, çeşitli patolojik sıvılar ve biopsi materyalleri,
Coccidioidomycosisde : Lenf yumrusu içeriği, pleural ve peritoneal eksudatlar ve diğer biopsi materyalleri,
Cryptococcosisde : Deri ve deri altında oluşan lezyonlu kısımlar, lenf yumrusu içeriği, idrar, spinal sıvı, kraşe, irin, vs.
Histoplasmosisde : Periferik kan, periton sıvısı, lenf yumruları içeriği, lezyonlu organlardan alınan biopsi materyallerin ve çeşitli eksudatlar.
Nocardiosisde : Lezyonlardan, lenf düğümü içeriklerinden, sekret ve ekskretlerden yeteri oranda materyal alınarak ve laboratuara gönderilir.
Yukarıda bildirilen ve teşhis amacıyla gönderilen materyaller, tekniğe uyularak ve aseptik koşullar altında alınırlar. İdrar muayeneleri için, özellikle, kataterle alınanı muayenelerde ve ekimlerde kullanılmalıdır.
İdrar, pleural ve peritoneal sıvılar laboratuarlarda kuvvetli santrifüje edildikten sonra, tortudan preparatlar ve ekimler uygulanır.
Gerekli hallerde, kan, kemik iliği ve diğer lezyonlu doku veya organlardan da yararlanılır.
Alınan materyallerin konulduğu kapların üzerine hastanın cinsiyeti, yaşı, hasta veya lezyonlu bölgenin adı, lezyonların karakteri, yerleri ve diğer önemli ve gerekli bilgiler yazılır ve böylece laboratuara gönderilir.
03. Materyallerin Muayenesi
Laboratuvarlara gönderilen patolojik materyallerin, türüne ve infeksiyonunun karakterine göre gruplandırılarak özel muayeneye tabi tutulurlar.
03.01. Kutan Mikozeslerde
Dermatofitoseslerin teşhisi için laboratuara, genellikle kıl, deri kazıntısı saç ve tırnaktan alınmış materyaller gönderilir. Bunların muayenesinde aşağıdaki sıra izlenir :
1- Ultraviolet ışığında (Wood ışığı) muayene: Bu muayene genellikle, infekte kılların saptanmasında yararlı olmaktadır. Bazı dermatofit mantarlarıyla infekte kıllar, ultraviolet ışığı altında sarı-yeşil veya yeşil-mavi bir parıltı gösterirler. Böyle kıllar pensle tutularak alınır, mikroskopik muayenesi ve ekimleri yapılır. Ancak, Wood ışığı altında fluoresensın görülmemesi, infeksiyonunun yokluğunu ifade etmez. Bu nedenle, kıllar, flüoresans versin veya vermesin, mikroskop altında muayene edilmeli ve ekimleri yapılmalıdır. Ultraviolet ışığı altında mantar türlerinin gösterebilecekleri flüoresans türü aşağıdaki çizelgede gösterilmiştir.
Wood ışığı altında infekte kıllarda fluoresans durumu :
E. floccosum Kılları infekte etmez
M. audouinii Parlak sarı-yeşilimsi fluoresens
M. canis " " " "
M. cookei Fluoresens yok
M. distortum Parlak sarı-yeşilimsi fluoresens
M. ferrugineum " " " "
M. gypseum Fluoresens yok veya çok açık yeşil
M. nanum " " " " " "
M. vanbreuseghemii " " " " " "
T. concentricum Kılları infekte etmez
T. equinum Fluoresens yok
T. gourvilii " "
T. megninii " "
T. mentagrophytes " "
T. rubrum " "
T. schoenleinii " " (bazen gri-beyaz veya parlak sarı yeşil fluoresens)
T. simii Yeşil fluoresens
T. soudanese Fluoresens yok
T. tonsurans Fluoresens yok (veya çok hafif)
T. verrucosum " "
T. yaoundei " "
Ultraviolet ışığı altında görülen fluoresens, mantarların metabolizma artıklarından ileri gelmektedir. Ancak, kıl veya deri kazıntılarına yapışmış olan bazı organik veya inorganik maddelerin fluoresens vermesi, bu yöntemin spesifitesini azaltmaktadır. Ayrıca, tırnak, keratin, petrol, salisilikasit, porfrinler, vb. maddeler de fluoresan verilebilirler.
Bu muayene karanlık bir yerde yapılır. Petri kutusunda bulunan örnekler bu ışığa tutularak fluoresens yönünden kontrol edilirler. Bu amaçla kullanılan wood ışığı için özel kutular yapılmıştır.
2- Direkt mikroskopik muayene : Laboratuvara götürülen materyalin cinsine göre, aşağıdaki tarzda özel muayeneler yapılır.
Kıllar ve Tüyler : Temiz bir lam üzerine, Lakto fenol pamuk mavisi veya Amman kloral lakto fenol solüsyonundan bir damla konulduktan sonra, üzerine, wood ışığı altında seçilmiş veya seçilmemiş kıllardan bazıları (5-6 tane kadar) pensle tutularak bırakılır. Üzeri bir lamelle kapatıldıktan sonra, mikroskop altında (200 x) muayene edilirler. Bu muayenede, kılların etrafında ve özellikle, kıl folliküllerinde miseller ve mantar sporları aranır.
Kılların muayenesinde, yukarıda bildirilen muayeneden başka % 10 - 20 KOH solüsyonu da çok kullanılır. Potasyum hidroksit, kıllar üzerinde bulunan bazı materyallerin erimesini sağladığından mantarları incelemek daha kolay olmaktadır. Ancak KOH uzun süre etkide bulunursa ve daha yüksek yoğunlukta kullanılırsa, dermatofit elementlerinin yumuşamasına ve dağılmasına neden olabilmektedir. Ayrıca, Candida türlerinin muayenesinde de, hücrelerde bozukluklar oluşturması nedeniyle, az kullanılmaktadır. KOH'ın etkilemesi için 30-60 dakika beklemek gerekmektedir. Bu süre içinde preparat çok hafifçe ısıtılabilir veya etüv ısısın da bulundurulur.
Deri kazıntıları : Deri kazıntıları, lâm üzerinde bulunan bir-iki damla %10-20 KOH solusyonuna batırılır ve üzeri lâmelle kapatılır. Hidrolizasyonu hızlandırmak için, alttan çok hafifçe ısıtılır (50-60 °C'de). Aynı amaçla, %10-20 NaOH, dimethyl sulphoxyde (%10-40) veya her ikisinin karışımı, veya KOH ile Parker boyası karışımı veya ince deri kazıntıları için sadece Metilen mavisi solüsyonu kullanılabilir. Hidrolizasyon (dermis veya derinin diğer kısımlarında bulunan keratinöz karakterdeki materyalin erimesi suretiyle berraklaşması) için ayrılan 30-60 dakikalık süre tamamlandıktan sonra preparat mikroskop altında önce küçük büyütme (100x-200x) ve sonra da büyük büyütme (450x - 500x) ile muayene edilir. Bu amaçla, kuru sistem objektif kullanılır ve iyi bir kontrast sağlanır.
Potasyum hidroksit (%5), 15-20 saatte ve %20 yoğunluğu ise 30-60 dakikada hidrolizasyon sağlayabilmektedir. Çok sayıda preparatı muayene için %5 lik KOH solüsyonu kullanılır ve preparatlar 24 saat sonra (ertesi günü) muayene edilebilirler.
Mikroskop altında dermatofit mantarlarının elementlerini (hifa ve sporlar) göstermede, %20 KOH ile %10 Parker boyası (Parker super chrom bleu-black Ink) karışımı, çok iyi sonuçlar vermektedir. Bu solüsyon bir ay kadar kullanılabilir.
Büyük deri parçaları ve keratinöz kütleler, steril bir havan içinde ezilir ve sonra, aynı yukarıdaki gibi muayeneye tabi tutulurlar.
Isıtmanın, her ne kadar hidrolizasyonu çabuklaştırması ve kısa bir süre içinde mikroskoba hazır etmesi gibi yararları yanı sıra, bazı araştırıcılar, kristal oluşumuna neden olması ve hücre elementlerini tahrip etmesi olasılığını ileri sürmektedirler.
Direkt mikroskopik muayenelerde, genellikle, mantara ait hifa ve artrosporlar aranır. Hifalar daha ziyade, branşlı ve septumludurlar. Lezyonlarda veya kıllarda rastlanılan artrosporlar, hifaların fragmentasyonu sonu meydana geldiklerinden, genellikle tesbih gibi diziler halinde bulunurlar. Sporlar, yuvarlak, oval veya silindirik bir biçimde olup 2 - 10 mikrometre boyutlarındadırlar. Mikroskop altında mantarların kılları infekte ediş tarzına çok fazla dikkat edilir ve bu durum mantar türlerini teşhiste yardımcı olur. Bazı mantar türlerinde (M. canis, M. audouinii, M. distortum, M. ferrugineum) sporlar kılların dışında lokalize olmuştur (ektotriks - ectothrix). Bu sporların çapları küçük olabilir (2-3 mikrometre) ve bu nedenle de ancak yüksek büyütmelerle görülebilirler. Bunlar ultraviolet ışığı altında parlak fluoresens verebilir. Bazı mantarların sporları daha büyüktür (5-8 mikrometre) ve kılların dışında dağınık ve seyrek olarak bulunurlar. Bunlar genellikle, fluoresens vermezler. Bu tür sporlara, M. gypseum, M. fulvum, M. nanum, M. vanbreuseghemii, T. gallinae 'de rastlanabilir. Böyle sporlar küçük büyültmeli mikroskop altında kolayca görülebilirler. Düzgün diziler halinde bulunan büyük sporlara, T. verrucosum, T. mentagrophytes, T. rubrum, T. megninii 'de tesadüf edilebilir. Mantarlara ait sporlar eğer kılların içinde lokalize olmuşsa, bu duruma endotriks ( endothrix ) adı verilmektedir. Böyle, kıllarda kırılma ve bükülmelere fazlaca rastlanır. T. tonsurans, T. violaceum, T. soudanese, T. yaoundei, T. gourvilii mantarlarında bu tarzda kıl invazyonuna rastlanabilir.
Mantarlar tarafından kılların invazyon türleri yandaki şekilde gösterilmektedir. | 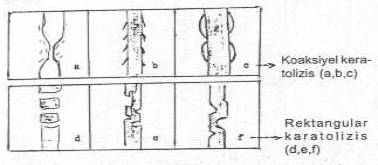
|
Bir kısım hifalarda kılların dip kısımlarında skutulum formasyonu görülür. Bazı hifaların içinde hava boşlukları olabilir(T. schoenleinii). T. concentricum ve M. persicolor da kıllarda hiç bir parazitizme rastlanmayabilir.
Tırnaklar : Tırnaklar aynı deri kazıntıları gibi muamele ve muayeneye tabi tutulurlar.
A) Ektotriks (ectothrix)
Mantar sporlarının kıllarda parazitlik durumları yandaki şekilde gösterilmektedir. | 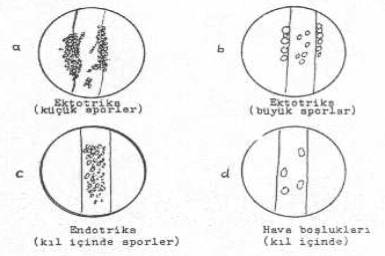
|
1-Kılların dışında küçük artrosporlar (2-4 mikrometre) ve Wood ışığı altında parlak fluoresens verirler.
M. canis M. distortum M. audouinii M. ferrugineum
2-Kılların etrafında az sayıda büyük artrosporlar (5-8 mikrometre) ve Wood ışığı altında fluoresens yok (39.2b).
M. gypseum M. fulvum M. nanum M. vanbreuseghemii T. gallinae
3-Kılların etrafında çok sayıda büyük artrosporlar, genellikle tesbih gibi dizili, fluoresans yok.
T. verrucosum T. mentagrophytes T. rubrum T. megninii
B) Endotriks (endothrix)
Artrosporlar kılların içinde lokalize olmuştur ve kıllar kolayca kırılabilir hale gelmiştir.
T. tonsurans T. violaceum T. soudanese T. yaoundei T. gourvilii T.schoenleinii
C) Endo-ektotriks (endo-ectothrix )
Kılların hem içinde hem de dışında artrosporlara rastlanır.
T. simii
D) Kıllarda herhangi bir invazyon yok.
T. concentricum E. floccosum T. persicolor
E) Kıl içinde hifalar
T. schoenleinii
03.02. Subkutan ve Sistemik Mikozeslerde
Teşhis için gönderilen patolojik materyalin türüne göre muayene yapılır.
İrin, idrar ve eksudatlar : Aseptik koşullarda alınan bu materyaller %10-20 KOH ile muamele edildikten sonra mikroskop altında muayene edilirler. Preparatların bir kısmı da Gridley, PAS, Giemsa, Gram, ve Ziehl-Neelsen gibi boyama yöntemlerinin biri ile boyanarak incelenirler. Boyama yönteminin seçilmesi şüphelenilen infeksiyonun türüne ve laboratuar elemanlarının kendi tecrübesine göre değişebilir.
B. dermatitidis, C. immitis, Aspergillosis türleri ve diğer mantarlar, boyanmadan yapılan preparatlarda (natif preparatlar) kolaylıkla görülebilirler.
İdrar ve eksudatlar, durumlarına göre, hem santrifüje edilmeden ve hem de kuvvetli santrifüje edilerek tortudan preparatlar hazırlanır ve yukarıda bildirilen muayeneler aynen uygulanabilir.
Spinal sıvı : Aseptik koşullarda alınan spinal sıvı kuvvetlice santrifüje edildikten sonra (4000 dev.\ dak., 15-20 dak.) dipteki tortudan temiz bir lâm üzerinde preparat hazırlanır, hem boyanmadan ve hem de çeşitli boyama yöntemlerinden biri ile boyanarak mikroskopta muayene edilir. C. neoformans için negatif boyama yöntemi uygulanabilir (Çin boyası ile).
Kan ve kemik iliği : Bu dokulardan da hazırlanan preparatlar PAS, Gridley, Gomori, Giemsa, Gram, Ziehl-Neelsen (veya Kinyoun) vs. boyama yöntemlerinden biri ile boyanarak mikroskop altında incelenirler.
Biopsi ve otopsi materyalleri : Alınan materyalin bir kısmı, %10 formalin (veya diğer fiksatiflerle) ile tespit edilerek histolojik muayeneler için kullanılır. Hazırlanan kesitler Gridley, Gomori, PAS, vs. boyama tekniklerinden biri ile boyanarak muayene edilirler. Materyalin diğer kısmından alınanlardan formolsuz ise yukarıda bildiren yöntemlerden birine göre preparatlar hazırlanır ve aynı zamanda ekimler için kullanılır.
Kraşe ve bronşial eksudat :Bu materyaller önce steril fizyolojik tuzlu su içinde 3-4 kez iyice yıkanarak oral flora ve yabancı materyallerin uzaklaştırılmasına çalışılır. Sonra yıkanmış materyallerden, çok temiz lâm üzerinde preparatlar hazırlanarak, hem boyanmadan ve hem de boyanarak mikroskop altında incelenirler.
Pleura ve periton eksudatları : Bu materyaller de, duruma göre, santrifüje edilmeden ve edildikten sonra dipteki tortudan, yukarıda bildirilen yöntemlere göre muayene edilirler.
Subkutan ve sistemik mikozeslerde direkt mikroskobik muayenelerde görülebilecek mantar elementleri, mantar türlerine göre değişiklikler gösterirler. Bunlar infeksiyonlara göre kısaca aşağıdaki gibidir.
Rhinosporidiosisde : Mikroskop altında, R.seeberi 'ye ait sporangium (sferula) 300-400 m.m çapında ve sporlar (7-9 m m) görülür. Sporangiumlar kalın duvarlıdırlar.
Sporotrichosisde : İnfekte materyallerde, S. schenckii 'ye ait uzunca oval, puro biçiminde, maya benzeri ve bazıları tomurcuklu hücrelere (2-3.6 m m) rastlanır.
Aspergillosisde : Dokularda veya eksudatlarda, bu mantara ait branşlı miselyumlar, konidiofor ve sporlara rastlanabilir.
Blastomycosisde : Mikroskop altında, büyük, yuvarlak veya oval, çift cidarlı ve bazıları tomurcuklu hücreler (8-20 mm çapında) görülebilir.
Candidiasisde : Patolojik materyaller içinde oval veya yuvarlak, bazıları tomurcuklu hücreler (2-5 mm) ve septumlu miseller bulunur.
Coccidioidomycosisde : Vücuttan elde edilen marazi maddeler içinde, oval veya yuvarlak (15-90 mm çapında), çift cidarlı ve içleri granüllü hücreler (sferulalar) ve bunların bazılarından çıkmış endosporlar görülebilir.
Cryptococcosisde : Dokulardan yapılan preparatlarda, kalın duvarlı ve kapsüllü, oval veya yuvarlak hücreler (5-20 mm) bulunur.
Histoplasmosisde : Patolojik materyaller içinde, mikroskop altında, oval veya yuvarlak, küçük (2-4 m m) hücreler ve bunların etraflarında bir veya birden fazla tomurcuk gözlenebilir.
Nocardiosisde :Lezyonlar, sekretler veya eksudatlar içinde branşlı ve asidorezistans küçük çomakçıklar tarzında N. asteroites 'e rastlanabilir.
04. Materyallerin Ekilmesi
Laboratuvara gönderilen materyallerden, şüphelenilen infeksiyonun türüne göre uygun besi yerlerine ekimler yapılır. Eğer, marazi madde yeterli ise, bunları 4 gruba ayırmak iyi bir tedbir olur. Materyal, 1-Mikroskobik muayeneler için, 2-Ekimler için, 3-Histopatolojik yoklamalar için, 4-Muhtemelen, tekrar gerekli olabilecek muayeneler için olmak üzere gruplandırılır. Laboratuara gönderilen patolojik materyal, hemen ekilemeyecek veya muayene edilemeyecekse, bu takdirde buz dolabı ısısında muhafaza edilirler. Ancak, 0°C ile 4° C arası ısısı, bazı flamentöz mantarlar için uygun olmayabilirler. Mantar örnekleri rutubetli bir ortamda, veya rutubetli bir tüpte, petri kutusunda, şişede, vs. kaplar içinde bulundurulmamalı veya muhafaza edilmemelidir. Çünkü, bazı saprofitik mantarlara ait sporlar, rutubetli ortam içinde filizlenebilir ve bu durum, etkilen besi yerlerinin kısa bir süre içinde kontaminasyonlarına neden olabilir. Böylece patojenik mantarların üremesini ve izolasyonunu güçleştirir veya imkansız hale gelir.
Kutan mikozes olgularından alınan materyallerin ekimlerinin bir kaç gün sonra yapılmasının bakteri kontaminasyonlarını azaltacağını bildiren araştırmacılar bulunmaktadır. Ancak, üretme ortamlarına antibiyotikler katıldığından, bakteri kontaminasyonlarının önemli bir engel oluşturamayacakları açıktır. Bu nedenle, laboratuvarlara materyaller ulaşır ulaşmaz ekilmeleri gereklidir.
Muayene materyallerin ekimlerinde, aynen bakteriyoloji laboratuarlarında uygulanan steril çalışma kuralları, burada da, izlenir. Ekim malzemesi ve besi yerleri steril olmalıdırlar.
Materyallerin laboratuvarlarda açılması ve ekimleri, mutlaka, özel kabinet (inokulasyon kabineti) içinde yapılmalıdır.
04.01. Kutan Mikozesler
Kutan mikozes olgularında, genellikle, kıl, tüy, deri ve tırnak kazıntıları gönderilir. Bu materyallerden petri kutusundaki besi yerlerinin 4-5 yerine, steril pensle ekimler yapılır. Kıl veya deri kazıntılarının, besi yerlerinin içine biraz batırılmasının, üreme şansını artırması bakımından önemi fazladır. Özellikle, kıl follikülleri pensle agarın içine biraz daldırılmalıdırlar. İzolasyonlar için, tüp veya şişeler yerine, daha geniş bir alan oluşturan, iyi bir mikroskobik görünüm sağlayan ve daha fazla ekimlerin yapılmasına olanak veren, petri kutularının kullanılması yerinde olur. Ayrıca, kontaminantları veya saprofitik olanları zamanında ve agarın yüzeyini kaplamadan görerek bunları uzaklaştırmak olanağını da sağlar.
İlk izolasyonlarda, sıvı besi yerlerinden pek yararlanılamaz.
04.02. Subkutan ve Sistemik Mikozesler
Bu infeksiyonlarda çeşitli patolojik materyallerden ekimler uygulanır. Vesikül sıvıları, irin ve bunun gibi materyaller, petri kutusundaki katı besi yerinin yüzeyine iyice yayılarak ekilirler. Serobrospinal sıvı, pleural ve peritoneal eksudatlar, hem sanrfüje edildikten sonra tortudan ve hem de sanrfüje edilmeden ekimleri yapılır. Doku parçaları iyice ezildikten veya çok küçük parçalara ayrıldıktan sonra ekilirler.
Sistemik infeksiyon oluşturan mantarlardan, H. capsulatum, C. immitis, B. dermatitidis, vb., ekimler petri kutusu yerine tüpteki katı ortamlara yapılması daha uygun olur.
İnokulasyonlar için kullanılacak besi yerleri, hastalık etkenini en iyi şekilde üretebilme yeteneğine sahip ve aynı zamanda selektif olmalıdırlar. Ayrıca, her türlü optimal koşullar sağlanmalıdır.
Mantarlar genellikle aerobik bir karaktere sahiptirler.
Kültürler, inkubasyonda 15-20 günden aşağı olmamak üzere tutulurlar. Ancak, bu süre mantarların türüne göre değişebilir. Bazı hallerde kültürün yüzeyi saprofitik mantarlarla kaplanabilir. Bu zaman, kısa bir süre içinde ve besi yerinin yüzeyini kaplamadan ya başka ortama ekim yapılmalı veya saprofitik mantar spor oluşturmadan, besi yerinden uzaklaştırılmalıdır.
Mantar hastalıklarına neden olan etkenleri izole etmek için kullanılacak besi yerlerinin türü, şüphelenilen hastalığa göre değişebilir. Ancak, son yıllarda çeşitli ticari firmalar tarafından pratiğe sunulan, özel ve selektif izolasyon ve identifikasyon besi yerleri bulunmaktadır. Bunlardan da aynı tarzda yararlanılabilir.
Dermatofitozeslere neden alan etkenlerin ilk izolasyonu için, direk marazi maddelerin muayene sonuçları ne olursa olsun, uygun besi yerlerine ekilmelidirler. Besi yerinin seçimi aranan etkene göre değişir. Her ne kadar besi yerlerine anti bakteriyel (kloramfenikol veya streptomisin + penisilin karışımı) ve antifungal (cyclohexamide =actidione) maddeler katılsa bile, hastalardan alınan örneklerde bakteriler ve özellikle saprofitik mantar kontaminasyonlarını önlemek önemli bir sorun olarak bulunmaktadır. En fazla kontaminant mantarlar Phycomyceteslere ait türler arasındadır. Bunlar üremelerinin başlangıcında, ayni dermatofitlere benzer koloni formu oluşturmakta ve bazen yanlış teşhise yol açmaktadırlar. Bu yönden dikkatli bulunmak gerekmektedir.
Laboratuarlarda, dermatofit ve diğer patojenik mantarların ilk izolasyonu için, bileşiminde kloramfenikol ve siklohekzamid (cyclohexamide) bulunan, Sabouraud dekstroz agar (SDA ) kullanılır. Bu ortamın pH'sı düşük olduğundan ve içerdiği antibakteriyel ve antifungal substanslardan dolayı, birçok bakterilerin ve saprofitik mantarların üremesini inhibe eder. Ancak, bu maddelere rağmen özellikle, saprofit bazı mantar üremesine rastlanabilir. Ortama, aktidion (actidione, 0.5 g/ lt), kloramfenikol (0.05 g / litre) veya bunun yerine streptomisin (40 mcg. / ml) ve penisilin (20 ui / ml.) karışımı konabilir. Bazı araştırıcılar, antifungal olarak, fungicidini önermektedirler (100 mcg. / litre). Bu madde, % 1 oranında dimethylformamide içinde eritildikten sonra kullanılır.
Dermatomikozese neden olan etkenleri izolasyonda, bazı laboratuarlar, Sabouraud dekstroz agarın yanı sıra veya ayrı olarak Littman-Oxgall agarından da yararlanılmaktadır. Ancak, bu ortamda koloniler, birinci besi yeri kadar tipik bir görünüme sahip değildirler. Bu nedenle, özellikle, identifikasyon için SDA besi yeri yeğ tutulmaktadır.
T. violaceum, T. verrucosum, T. concentricum, T. ferrugineum ve T. tonsurans gibi dermatofitleri üretmede besi yerine tiamin ( 0.05 g / litre ) katılması üreme şansını artırır. Ayrıca, T. equinum için nikotinik asit ve T. gallinae için histidin üretme faktörü olarak kullanılmalıdır.
Subkutan ve sistemik mantar infeksiyonlarında da genellikle, Sabouraud dekstroz agar kullanılırsa da, bundan ayrı olarak, Beyin-kalp infusyon agarı veya aynı ortamın kanlı agarı, Sabhi agardan da büyük ölçüde yararlanılır. Bu ortamların bileşiminde, siklohekzamid (0.5 g. / litre) ve kloramfenikol (0.05 g. / litre) bulunabilir. Ancak, antifungal madde, Cryptococcus ve Candida türlerinin izolasyon ve identifikasyon besi yerlerinde bulunmamalıdır. Üremeyi inhibe edebilir.
İnokule edilen besi yerleri, dermatofit izolasyonu için 25o - 26o C. aralarında inkubasyona konurlar. Ekimlerin çift olarak yapılması ve birinin 37oC tutulması gereklidir. Ancak, bu ısı (37oC) dermatofitlerin çoğunu inhibe eder. Sistemik infeksiyonlara neden olan mantarların izolasyonu için de çift ekimler yapılır ve biri 37oC. tutulur. Bu ısıda dermatofit mantarların parazitik formu (maya benzeri form) elde edilir.
Kontamine olmuş kültürleri temizlemek için sulandırma (bir özeye 10-15 spor düşecek tarzda) yöntemi kullanılır. Bu miktar inokulum, 45oC'ye kadar ılıklaştırılmış agarla iyice karıştırıldıktan sonra petri kutusuna dökülür. Bir kaç gün sonra (veya koloniler görülmeye başladıktan sonra) seçilen koloni veya koloniler başka bir besi yerinin ortasına inokule edilir. Uygun bir süre inkubasyonda tutulduktan sonra (koloni iyice görüldükten sonra ) kenarlarından alınan inokulum taze bir ortama aktarılır. Bazı durumlarda, işlemi birkaç kez yinelemek gerekebilir.
Primer kültürlerde, dermatofit mantarlar, genellikle, 4-15 gün içinde koloni oluştururlar. Kültürler 4 günden sonra her gün veya gün aşırı, sabah ve akşam, düzenli olarak kontrol edilir ve 3 hafta kadar inkubasyonda bırakılır. Bu arada patojenik mantarlar bakımından şüpheli görülen koloniler, zaman geçirmeden ve kontaminantların bulaşmasına meydan vermeden, başka ortama aktarılırlar. Üç hafta sonra, her hangi bir üreme görülmeyen besi yerleri negatif kabul edilirler. Ancak, marazi maddelere bir şans daha tanımak istenirse, bu sefer 15 - 20 gün sonra, tekrar ekilmelidirler. Bu zaman, iki ayrı izolasyon besi yeri kullanılmasının yararı bulunabilir. Kültürlerde kontaminasyonun varlığı anlaşılırsa, hemen subkültür yapılmalıdır. Eğer birden fazla koloni varsa, bunlar ayrı ortamlara nakledilmelidirler. Kültürleri muayene ederken çok yavaş hareket etmeli ve petri kutuları, mümkünse, pek fazla kıpırdatılmamalıdır. Aksi hallerde saprofitik mantar (Aspergillus, Penicillium, Mucor, v.s.) sporları, patojenik mantar kolonilerini kontamine edebilirler.
Besi yerlerini petri kutularında kullanmak, geniş bir yüzey sağlaması ve görmeyi kolaylaştırması bakımından çok faydalıdır. Ancak, insanlara bulaşan sistemik mikozeslerde ağzı kapaklı tüp kullanmak iyi bir tedbir olur.
Çeşitli mantar hastalıklarında alınacak materyalin ve izolasyon için kullanılacak besi yerlerinin türü aşağıdaki çizelgede gösterilmiştir.
Mantarların antifungal ve antibiyotikli ortamlarda izolasyonu sağlandıktan sonra, subkültürlerinin yapılması için ayrı besi yerleri kullanılmalıdır. Bu besi yerinde antifungal madde konmayabilir. Pasajlar aynı bakterilerde uygulanan yöntemlerle devam ettirilir. Eğer identifikasyon yapılacaksa, alınan inokulumlar, diğer besi yerinin tam ortasına ekilmelidirler. Üreme meydana geldikten sonra kültürler muayene edilir. İdentifikasyon için özel selektif besi yerlerinden yararlanılabilir.
[1] Kaynak : Temel Mikrobiyoloji