Nukleik Asitlerin İn Vitro Amplifikasyon Yöntemleri
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji 1
01. Giriş
02. DNA Amplifikasyon Teknikleri
03. Polimeraz Zincir Reaksiyonu(PZR)(Polymerase Chain Reactıon, PCR)
03.01. PZR’nin Çalışma Prensibi
03.02. Polimeraz Enzimleri
03.03. Hedef DNA Kaynakları
03.04. Primerlerin Seleksiyonu
03.05. Amplifiye Edilmiş Ürünlerin Saptanması
03.06. PZR’da Oluşan Hatalar
03.07. PZR’ın Başlıca Kullanım Alanları
04. Polimeraz Zincir Reaksiyonunun (PZR) Modifikasyonları
04.01. İnvers (tersine dönmüş) Polimeraz Zincir Reaksiyonu
04.02. Asimetrik Polimeraz Zincir Reaksiyonu
04.03. Homopolimerli Polimeraz Zincir Reaksiyonu
04.04. İn Situ Polimeraz Zincir Reaksiyonu
04.05. Hot Start Polimeraz Zincir Reaksiyonu
04.06. Multipleks Polimeraz Zincir Reaksiyonu
04.07. Kantitatif Polimeraz Zincir Reaksiyonu
04.08. Nested Polimeraz Zincir Reaksiyonu
01.Giriş
Nukleik asitlerin (DNA veya RNA) in vitro amplifikasyonları (sayısal çoğaltılması), patojenlerin ve dolayısıyla da infeksiyonların, tümörlerin, genetik hastalıkların teşhisinde ve adli tıpta, en fazla kullanılan yöntemlerin arasında yer almaktadır.
Amplifikasyon yöntemlerinde, çeşitli organ, doku ve sıvılardan izole edilen genetik materyaller veya sekanslar enzimatik olarak çoğaltılır. Sayısı artırılan genetik ürünler (amplikon), ya homolog işaretli problar kullanılarak hibridizasyonla, veya elektroforezis ve boyamadan sonra direkt görüntülenerek ortaya konulurlar.
Amplifikasyon teknikleri, katı ortamlarda bakterilerin çoğalarak görülür hale gelmesi (koloni oluşturması) ile özdeşleştirilebildiği gibi, patojenlerin (veya antijenlerin) vücuda girdikten sonra oluşan spesifik antikorların ortaya konmasıyla de benzerlik gösterir. Şöyle ki, vücutta, çok az miktarda antikor bulunabilir bunlar bazı özel immunolojik testlerle (ELİSA, İFA, RİA, vs.) belirlenebilirler, aynen vücutta çok az sayıda genetik materyallerin amplifikasyon yöntemleriyle saptanabilmesi gibi. Ayrıca, vücutta hiç bir hastalık oluşturmadan veya antikor sentezini uyarmadan bulunabilen fakat başka bireyler için patojenik olabilen mikroorganizmaları, latent, gizli, kronik infeksiyonları, portör, rezervuar ve nesli tükenmiş hayvanları saptamada amplifikasyon teknikleri daha güvenilir ve çabuk sonuçlar vermekte ve epidemiyolojik çalışmalara büyük kolaylıklar sağlamaktadır. Ancak, genetik materyallerin, vücutta immun responsun meydana gelmesinden veya tedaviden sonra ne kadar süre sonraya kadar kalabildiği ve teşhis için işe yarayabileceği henüz tam belirlenmiş değildir. Ancak, şunu da belirtmek gerekir ki, donmuş fosillerden elde edilebilen genetik materyaller amplifikasyonda kullanılabilmekte ve genetik materyaller uzun yıllar bozulmadan kalabilmektedirler.
Amplifikasyon yöntemlerinin çabuk, güvenli, sensitif ve spesifik olmaları, kandaki antikorlardan, materyallerin eskiliğinden, etkenlerin vücutta çok az sayıda veya inaktif olmalarından etkilenmemeleri nedeniyle, izolasyonları, üretilmeleri veya identifikasyonları çok zor olan bakteriyel ve viral ajanların belirlenmesinde büyük yararlar sağlamaktadır. Bu teknikler, ayrıca, zamandan ve personelden büyük tasarruf sağlamasına, personel hatalarını ve laboratuvar infeksiyonlarını minimal düzeye indirmesine karşın, halâ, pahalı, deneyimli ve bilgili personele, gelişmiş malzemeye, saf kimyasal maddelere, işaretli problara, enzimlere, spesifik primerlere vs. gereksinim vardır. Aynı zamanda, vücutta, herhangi bir infeksiyon oluşturmayan mikroorganizmalar (apatojenik, kontaminantlar, vs.) kros reaktif olarak tespit edilebilmekte, sonuca ve yorumlamaya ters yende etkilemektedirler. Laboratuvarlarda aseptik ve/veya steril koşullara uyulmadığı durumlarda kontaminasyonlar (amplifiye olmuş DNA sekansları ile) fazla olmakta ve fazla kullanılan pipet, solüsyon, reagent, kimyasal vs. de bulaşmalar görülmektedir. Bunlar da, işaretli problar, veya primerler aracılığı ile amplifiye olmaktadırlar. Bunların yanı sıra, serolojik, kültürel, klinik, biyopsi ve otopsi bulguları negatif olan bir olguda sadece amplifikasyon yöntemleriyle alınan pozitif reaksiyonun değerlendirilmesi veya yorumlanması da oldukça zordur.
Şunu da unutmamak gerekir ki, amplifikasyon yöntemleri, hiç bir zaman direkt teşhis metotları değildir. Bunlar tanıya büyük yardımı ve desteği olan çok duyarlı, sensitif, çabuk ve güvenilir testlerdir. Bu üstünlüklerine karşın, amplifikasyon prosedürlerinin, belirtilen bazı dezavantajlarından dolayı, bazı araştırıcılar, diğer kolay ucuz ve duyarlı klasik laboratuvar teknikleri denendikten sonra, şüpheli veya sonuç alınamayan olgularda, kullanılmasının yerinde olacağını bildirmektedirler.
Amplifikasyon yöntemlerini 3 grupta incelemek yerinde olur.
1) DNA’nın amplifikasyonu
2) Transkripsiyonla amplifikasyon
3) Prob moleküllerinin amplifikasyonu
Bu bahiste sadece grup-1 işlenecektir.
02. DNA Amplifikasyon Teknikleri
Bu teknik, klinik materyallerde bulunan veya izole edilen etkenlere ait DNA’ların veya bazı spesifik sekansların in vitro olarak enzimatik amplifikasyonlarını amaçlar. Pratikte de, bu DNA amplifikasyon yöntemi, diğerlerine oranla daha fazla uygulama alanı bulmuştur. RNA karakterindeki genomik materyaller de önce, revers transkriptaz (RT) ile komplementer DNA’ya (cDNA) çevrilerek amplifikasyonu yapılır.
DNA amplifikasyonunun en yaygın ve önemlisini Polimeraz Zincir Reaksiyonu (PZR) oluşturmaktadır. Bu nedenle teknik hakkında aşağıda gerekli bilgiler verilmektedir.
03. Polimeraz Zincir Reaksiyonu(PZR)(Polymerase Chain Reactıon, PCR)
Son yıllarda, özellikle, 1980’li yılların başından itibaren, genetik materyaller üzerindeki çalışmalar, nukleik asit karakterizasyonunda, moleküler klonlamada, sekans analizlerinde, rekombinant teknolojisinde ve klinik uygulamalarında nukleik asit tabanlı problardan yararlanma olanakları giderek artmıştır. Ayrıca, prokaryotik ve ökaryotiklerin genomlarındaki modifikasyonlar, restriksiyon analizleri ve sistemleri üzerinde de son zamanlarda yoğun çalışmalar yapılmaktadır. Saiki ve ark. (1985) tarafından, mevcut yöntemlerin duyarlılıkların artırılmasından ziyade, DNA veya RNA baz sıralarının sayısal olarak artırılması (amplifikasyon) teknolojisine dayanan ve dolayısıyla de mevcut yöntemlerle analiz edilebilmelerini sağlayan, Polimeraz zincir reaksiyonunu (PZR) geliştirmişlerdir.
PZR’ın geliştirilmesi, moleküler teknolojinin ve aynı zamanda, kullanım alanının da genişlemesine yol açmıştır. PZR, son yıllarda, biomedikal araştırmalar yanı sıra infeksiyöz ajanların teşhisinde, epidemiyoloji, genetik defektlerin saptanmasında, adli tıp ve diğer alanlarda da geniş bir uygulama ortamı bulmuştur.
03.01. PZR’nin Çalışma Prensibi
Bir çok disiplinde olduğu gibi, insan ve veteriner hekimlikte de çok büyük yararlar sağlayan PZR’ın çalışma prensibi, oldukça basittir. Özet olarak, izole edilen veya patolojik materyallerde bulunan hedef genetik materyallerin (DNA veya RNA), spesifik kısa zincirli oligonukleotid primerler yardımı ile, enzimatik olarak sayısal çoğaltılması (amplifikasyon) olarak tanımlanabilir. Bu hedef genetik materyal çok az sayıda ve hatta, bir çok veya sayısız diğer veya ilgisiz DNA’lar arasında olsa bile çoğaltılabilir ve homojen bir DNA materyali haline getirilebilir ve kolayca da identifiye edilebilir.
PZR küçük volumler halinde hazırlanır. Şöyle ki, 0.5 ml mikrofüj tüpüne 100 µl. hacimde materyal konur. Bu materyaller arasında,
1) Aranan hedef DNA sekansları,
2) İki tür spesifik oligonukleotid primerleri (15-30 bazlık, tek iplikcikli),
3) Termostabil DNA polimeraz (Taq polimeraz veya diğerleri)
4) Dört tür dNTP (dATP, dCTP, dGTP, dTTP) bulunur.
PZR aşamaları yandaki şekilde gösterilmektedir. | 
|
Bu ön hazırlıklar tamamlandıktan sonra, PZR başlıca 3 aşamada gerçekleştirilir. Bunlar da,
1) Hedef DNA’nın denatürasyonu: Bütün gerekli materyaller çok küçük miktarlarda mikrofüj (Ependorf, vs.) tüplerine konduktan sonra özel bir aletin (Thermal cycler) gözlerine yerleştirilir. Alet otomatik olarak ısıyı 95°C’ye yükselterek bu ısıda hedef DNA’ların denatürasyonu (nukleik asitin iki iplikçiğinin birbirlerinden ayrılarak tek iplikçik haline gelmesi) sağlanır. Bu işlem için, materyalin türüne göre değişmek üzere 3-5 dakika kadar bir süre yeterli olmaktadır.
2) Primerlerin bağlanması: Ayarlanmış olan süre sona erdikten sonra, alet ısıyı, 50-52°C ye indirerek ortamda bulunan iki tür primerin, her birinin komplementeri olduğu tek iplikçik hedef DNA üzerindeki spesifik sekanslara bağlanması gerçekleştirilir. Şöyle ki, primerlerden biri kendine ait 5'-terminusu ile hedef DNA’lardan birinin 3'-ucu ile ve diğer primerler de, ikinci tek iplikçik DNA’nın, antiparalel olan diğer ucunda bulunan 3'-ucuna bağlanarak, DNA polimerazın çalışma yönüne uygun olarak (5' ®3') bağlanırlar. Bu işlemlerin tamamlanması da yaklaşık yine 3-5 dakika kadar devam eder.
3) Polimerizasyon: Bu bağlanma süresi bitince aletin ısısı hemen 70- 72°C’ye çıkarak, tüpler içinde bulunan ve ısıya dayanıklı olan Taq polimeraz enzimi, 5®3 yönünde olmak üzere, ortamdaki nukleotidleri kullanarak, primerlerin 3'-terminusuna nukleotidleri yerleştirir ve böylece hedef DNA sekansının bir kopyası elde edilir. Polimerizasyon reaksiyonunda, hedef DNA’nın tek iplikçik sekansları kalıp ödevi görür. Bu süre de yaklaşık 3-5 dakika sürmektedir.
Böylece, PZR’ın 3 aşamadan oluşan ve yaklaşık olarak 10-15 dakika kadar devam eden birinci amplifikasyon aşaması, tekrar ısının 95°C’ye yükseltilmesi ve aynı aşamaların 25-30 kez tekrarlanması durumunda tek bir hedef DNA segmenti, 2n formülüne göre, yaklaşık 33.6 milyon çoğaltılmış olur. Ancak, deney koşullarında gerçekleşen verim oranı %85 kadardır. Bunda esas faktörü, dönem sayısı arttıkça verimin düşmesi oluşturmakta, enzimin tanıması gereken nukleotidlerin sayısının fazla olması, tekrarlanan ısı değişiklikleri ve artışların da enzimin aktivitesine olumsuz etkilemesinin önemli rolleri bulunmaktadır. Taq polimeraz enziminin yaklaşık, her 1000 nukleotidde bir nukleotid kadar hata yapması, sentezlenen yeni cDNA’ya yanlış nukleotidlerin girmesine de yol açmaktadır. Hata oranı (m), m=2f/c formülü ile hesaplanmaktadır (burada f: nukleotidlerin zincire katılmasındaki hata ve c: ise dönem sayısı).
PZR’nın istenilen doğrultuda devam etmesinde reaksiyon tüplerine konan primerlerin ve dNTP’ların sayılarının ve her aşamada uygulanan sürenin çok önemli rolleri bulunmaktadır. Bu süre hedef DNA’nın türüne göre 3-5 dakika arasında değişebileceği ancak süre ayarlamada araştırıcıların bilgi ve beceri düzeylerinin de katkılarının fazla olacağını unutmamak gerekir.
Termostabil Taq polimeraz veya diğer termostabil enzimler, bilinçli olarak seçilmelidirler. Başlangıçta enzimin bir defa ve 25-30 siklus için yeterli olabilecek miktarda katılması da önemlidir.
03.02. Polimeraz Enzimleri
Orijinal PZR teknolojisinde, ilk önceleri, E.coli ' den izole edilen DNA polimeraz enzimi kullanılmıştır. Bu enzim termolabil olduğundan ısının 95°C’ye çıkarılması halinde, enzim inaktive olmaktaydı. Bu dezavantajı gidermek için, her periyodda yeniden enzim katılması zorluğu, ısıya dayanıklı enzimin bulunması gereğini ortaya koymuştur. İlk termostabil DNA polimeraz, Thermus aquaticus’dan izole ve pürifiye edilmiştir (110 kD, Taq polimeraz). Bu mikroorganizma Yellow Stone Ulusal Parktaki sıcak su kaynaklarından izole edilmiştir. Taq polimerazın 95°C’deki yarı ömrü yaklaşık 40 dakika kadardır. Bunun, 61 kD’luk StoffeI fragmentinin daha yüksek ısıya dayanıklı olduğu açıklanmış ve G + C’lerden zengin bazlara sahip hedef DNA’ların amplifikasyonunda daha etkili olduğu belirtilmiştir. Bu fragment aynı zamanda geniş bir Mg iyon konsantrasyonununda (2-10 mM) aktivite gösterebilmektedir. Böyle bir durum, aynı reaksiyon tüpünde, 2 veya daha fazla farklı (veya değişik) hedef DNA sekanslarını da aynı reaksiyon ortamında amplifikasyonuna olanak sağlamaktadır (multipleks PZR).
Son yıllarda, bir çok termostabil polimeraz enzimi izole, identifiye, pürifiye edilmiş ve denenmiştir. Bunlar arasında, Thermococcus literalis ’den izole edilen Vent polimeraz, Thermus thermophilus ’dan Tth polimeraz ve Pyrococcus furiosus ’dan da Pfu polimeraz enzimleri elde edilmiştir. Bu 3 termostabil enziminin birbirinden ve Taq polimerazdan bazı üstünlükleri bulunmaktadır. Örn., Taq polimerazın 3' ® 5' ekzonukleaz aktivitesi bulunmamaktadır. Bu durum, DNA’nın amplifikasyonu sırasında yanlış bazların sıraya girmesi halinde (her 1000 bazda bir baz) bunları tanıyarak çıkaramamakta, böylece sentezi sürdürmekte ve uygun olmayan bir polimerizasyona yol açmaktadır. Bu yanlış bazların sıraya girme problemi, ortama katılan baz sayısının ve Mg Cl iyon konsantrasyonunun azaltılması ile giderilmeye çalışılmıştır. Vent polimeraz enziminin tashih etme (3'®5' ekzonukleaz aktivite, yanlışlıkları düzeltme) özelliği bulunmakta, ortamda fazla dNTP’ların ve Mg Cl iyonların bulunması durumunda, Taq polimerazdan daha iyi bir etkinlik göstermektedir. Ayrıca, bu enzimin yarı ömrü de daha uzundur. Tth polimerazda çok spesifik olup DNA’ya bağımlı DNA polimeraz aktivitesi yanı sıra, RNA’ya bağımlı DNA polimeraz aktivitesi de (revers transkriptaz) bulunmaktadır. Bu yönden Tth polimerazın Taq polimeraza üstünlüğü bulunmaktadır. Pfu polimeraz enzimi de termostabil olup optimum aktivitesi 75°C’dedir. DNA sentezleme kapasitesinin Taq polimerazdan 12 kez daha fazla olduğu ve ayrıca hata yapma olasılığının ise daha düşük olduğu açıklanmıştır. Ancak, yüksek ısı yönünden etkinliği, Taq polimerazdan daha geride kalmaktadır.
03.03. Hedef DNA Kaynakları
PZR için her türlü kaynaktan temin edilen DNA (veya RNA) kullanılabilir. Kan, serum, vücut sıvıları, dokular, organlar, fikse edilmiş dokular, vs. çok fazla yararlanılan materyaller arasındadır. PZR’nin çok duyarlı olması, çok az miktarlardaki örneklere gereksinim duymaktadır. Örn., tek bir saçtan elde edilen hücre(ler)den sağlanan genomik DNA yeterli olabilmektedir. Ayrıca, örneklerden elde edilen DNA’ların da pürifiye edilmelerine gereksinim yoktur. Bu nedenle de hedef örneklerin hazırlanmasında deterjanlar (Nonidet P40, Tween 20 ve/veya Triton X100, vs.) veya Chelating ajanlar hücre membranlarının parçalanmasında kullanılabilirler. Proteinaz K’den de sellüler proteinlerin ayrıştırılmasında yararlanılabilmektedir.
Her ne kadar bazı organik solventler (fenol, kloroform, vs.) amplifikasyon üzerine zararlı etkisi olmadığı bildirilmişse de kullanılırken iyi bir seçim yapılmalıdır. Kan veya deparafinize edilmiş dokular, histolojik, patolojik, metabolik, tarihsel materyaller, PZR ile amplifikasyonda kullanılabilirler.
03.04. Primerlerin Seleksiyonu
Sentetik olarak kolayca hazırlanabilen tek iplikcikli spesifik DNA segmentleri olan primerler, kullanılma amaçlarına göre, 15-40 oligonukleotidden oluşmuşlardır. Bunlar, hedef DNA üzerinde kendine komplementer olan baz sıralarını bularak onlara bağlanır ve buradan (3'-OH terminus) DNA sentezinin ilerlemesine basamak teşkil ederler. Primerlerin yapısında, % 50-60 kadar G + C bazların bulunması, hedef DNA ile daha kuvvetli bağların kurulmasına yardımcı olur. Ayrıca, böyle birleşmeler, yüksek ısıda oluşturulan amplifikasyonda nonspesifik bağlanmaları da azaltır.
Primerlerin 3'-ucundaki bazların, hedef DNA’nın kopyasının çıkması işlemini başlatmada, önemleri fazladır. Bu nedenle primerlerin 5'-ucu, hedef DNA’nın 3'-ucu ile birleşerek, polimerizasyon için 5' ® 3' yönünde uygun bir ortam yaratmaktadır. Yeni bazlar, primerin 3'-terminusuna, kalıp DNA örnek alınarak seçilir ve ilave edilirler. Bu uçtaki tek bir uyumsuzluk polimerizasyonun etkinliğini azaltır.
Primerler o tarzda seçilmeli veya hazırlanmalıdırlar ki, kendilerinde bulunan baz sıraları, sadece hedef DNA üzerinde bir bölgede bulunmalı başka yerlerde veya başka hedef DNA sekanslarında bulunmamalıdır. Eğer bu kurala uyulmazsa, kros amplifikasyonlar meydana gelerek sonuca ve yorumlamaya olumsuz yönde etkilerler. Bu nedenle, her ne kadar ön koşul olmamakla beraber, hedef DNA’nın saf olmasının büyük yararları bulunmaktadır. Diğer önemli bir noktada, hedef DNA baz sıralarının çok iyi bilinmesi ve bunlar üzerindeki spesifik bölgelerin seçilmesi ve başka bir ajanda bulunmamasına gayret gösterilmelidir.
Böyle yanlışlıkları önlemek için, kullanılmadan önce primerlerin spesifiteleri, rutin muayenelerle denenmeli uygun bulunanlar testte kullanılmalıdırlar.
Primerler yanı sıra reaksiyon ortamına katılan nukleotidler ve solüsyonların da dikkatle seçilmesi ve kullanılmasına azami özen gösterilmelidir. Bunlar, kesinlikle, kontamine olmamalıdırlar.
03.05. Amplifiye Edilmiş Ürünlerin Saptanması
PZR’dan sonra amplifiye edilmiş ürünlerin ortaya konulması önemli ve yapılması gereken bir işlemdir. Bu amaçla başlıca 4 tür uygulama kullanılmaktadır.
1) Ethidium bromidle bantların boyanması: Reaksiyon tüplerinde bulunan amplifikasyon ürünleri, buradan direkt olarak agarose jel elektroforezise (veya PAGE) tatbik edilir. Bu ortamda, ürünler molekül ağırlıklarına göre bir separasyona tabi tutulurlar. Bu işlem sonunda, jel, Ethidium bromide solusyonuna daldırılarak, oluşan bantlar görülür hale getirilirler. Meydana gelen bantlar, bilinen kontrol bantlarla karşılaştırılarak bir değerlendirme yapılır. Çok basit ve aynı zamanda kolay olmasına karşın bu tekniğin bazı dezavantajları bulunmaktadır. Bunlardan biri, boyama tekniğinin sekans spesitesi zayıftır. Çünkü, istenmeyen veya ilgisi olmayan DNA’lar da amplifiye olabileceğinden bunlar bant analizleri ile belirlenememektedirler. Her ne kadar, kontrol setler kullanılsa bile yine de böyle sorunlar ortaya çıkmaktadır.
2) Southern blot analizi: Amplifiye olmuş ürünler, aynen yukarıdaki teknikte olduğu gibi, agarose jel elektroforezis (veya PAGE) tabi tutularak molekül ağırlıklarına göre bir separasyona tabi tutulurlar. Bu aşamadan sonra, agarose jelden katı ortama (nitroselüloz filtre veya naylona) transfer edilirler (elektro transfer). Bu katı ortam üzerinde denatüre ve fikre edildikten sonra, işaretli (32P, biotin, vs.) spesifik problarla hibridizasyona tabi tutulur ve sonuçlar otoradyografi veya biotin kullanılmış ise renk indeksine göre değerlendirilirler. Film üzerinde siyah lekelerin (bantlar) bulunması hedef DNA’nın amplifiye olduğunu ortaya koyar.
Southern blotting tekniğinin sensitivitesi ve spesifitesi daha yüksektir. Ancak, bu teknoloji de zaman alıcı ve fazla iş gerektirir.
3) Solüsyon hibridizasyon tekniği: Daha az olarak başvurulan bu teknikte, amplifiye edilmiş DNA ürünleri, işaretli problar uygun NaCl yoğunluğuna sahip bir hibridizasyon solüsyonu içinde bir araya getirilirler. Karışım 95°C’de denatüre edilerek, DNA iplikçikleri birbirlerinden ayrılırlar. Solüsyon, 50-60°C’ye kadar ılıklaştırılarak spesifik probların sekanslara bağlanması sağlanır. Bu karışım, poliakrilamid jel elektroforezis (PAGE) tabi tutularak separe edilir. Jel içerisinde DNA x DNA hibrid molekülleri büyük olduğundan ve yavaş harekete sahip olacaklarından, başlangıçta yer alırken, küçük moleküller (birleşmemiş problar, tek iplikçik DNA, vs.) daha hızlı hareket ederek karşı uçta lokalize olurlar. Bundan sonraki işlemler aynen Southern blottingde olduğu gibi yürütülür ve değerlendirilir.
4) Diğer teknikler: Amplifiye ürünleri (amplikon) belirlemeye, diğerlerinin dezavantajlarını ortadan kaldırmaya yönelik, bazı teknikler de geliştirilmiş ve denenmiştir.
a) Spesifik problarla hibridize olmuş DNA moleküllerinde, polimeraz enziminin 5'®3' yönündeki ekzonukleaz aktivitesi, hibridize olmuş probları ayrıştırarak 5'-uçlarında izotop bulunan prob DNA’sının boyutlarında küçülmeler oluşturur ve bunlar da otoradiografı ile ortaya konulurlar.
b) Hibridizasyon proteksiyon testi de aynı amaç için denenmiştir. Bunda, ayrıca, dijital okuma sistemleri de bulunmakta ve süre çok kısalmaktadır.
Amplifiye ürünleri saptamada, son yıllarda, nonizotopik probların kullanılması yönünde bir eğilim bulunmaktadır. Biotin veya digoxigeninle işaretlenmiş probları hazırlamak daha kolay ve daha uzun süre de kullanma olanağı sağlamaktadır.
03.06. PZR’da Oluşan Hatalar
PZR’ın çok yaygın kullanılmasına karşın, reaksiyon sırasında oluşan bazı hatalar negatif veya pozitif yanlış değerlendirmelere neden olabilmektedir. Bunların minimal düzeye indirilmesi araştırıcıların ve laboratuvarda çalışan teknik elemanın esas görevleri arasında olmalıdır. Ancak, bunların bir kısmı temiz çalışmamaktan kaynaklanmakta, diğer bir bölümü de çalışanların bilgisi dışında oluşmaktadır. Bu hataların neler olabileceğini iyi bilen teknik kadro, böyle olumsuz durumları en az düzeye indirebilir.
Laboratuvarda kullanılan bir çok bileşikler PZR’da amplifikasyonu önlemekte veya olumsuz yönde gelişmesine yol açmaktadır. Bunlar arasında deterjanlar, chelating ajanlar (EDTA), proteinazlar, kanser kemoterapötik ajanları, RNA ve EDTA düzeyinin yüksek olması, Heparin, Urasil, fenol kalıntısının bulunması, PZR’nin duyarlılığına olumsuz etkileyen faktörlerin belli başlıları arasındadır. Bunlar, reaksiyon sırasında, DNA veya RNA ile bağlanabilir veya bazlar arasına girerek sonuca olumsuz yönde etkileyebilirler.
Her ne kadar PZR’da ısıya dayanıklı enzimler kullanılmakta ise de, bunların etkinliklerinin, yüksek ısıdaki yarı ömürlerinin çok iyi saptanması ve ondan sonra kullanılmaları şarttır. PZR’ın dışında ki, 3SR, TAS vs gibi metotlarda genellikle, termolabil enzimlerden yararlanıldığından bunları kullanmadan önce gözden geçirilmesinde büyük yarar bulunmaktadır.
PZR’da en fazla görülen hataların başında non spesifik DNA’ların (non target DNA’lar) amplifiye olması ve sonuca etkilemesidir. Böyle amplifiye olmuş moleküllerin laboratuvarlarda birikmesi, örnek materyallere, pipetlere, solüsyonlara, kimyasallara, pipet uçlarına, vs. bulaşması istenmeyen olguların meydana gelmesine neden olur. Kontaminasyon problemini minimal düzeye indirebilmek ve bu düzeyde tutabilmek için fiziksel, kimyasal ve enzimatik kontrollere ve özel önlemlere gereksinim vardır. Şöyle ki, reagentler bir defa kullanılmalı, teknisyenler kontamine olmamış eldivenler takmalı, PZR ve diğer işlemler için (amplifikasyon, örneklerin hazırlanması, amplifiye ürünlerin saptanması, elektroforezis, vs.) ayrı ayrı odaların bulunması, odalar arası çeşitli materyallerin ve solüsyon nakillerinin çok sınırlandırılması veya hiç yapılmaması, gibi önlemler, nonspesifik amplifikasyonları çok azaltır.
Hedef olmayan DNA’ların ampflikasyonunda, iyi seçilmemiş bazlara sahip probların hazırlanmasının ve kullanılmasının da rolü büyük olmaktadır.
Son yıllarda amplifiye edilen ürünlerin sterilizasyonuna yönelik bazı teknikler geliştirilmiş ve başarı ile kullanıldığı açıklanmıştır. Bunlar arasında, dUTP (deoksi urasil trifosfat) ve UDG (urasil DNA glikosilaz) gibi kodlarla belirtilen yöntemler bulunmaktadır. Bunlardan ayrı olarak da, bazı araştırıcılar negatif kontrol kullanmayı tavsiye etmektedirler. Şöyle ki, reaksiyon sonunda negatif kontrol, pozitif çıkarsa, bütün test ekarte edilir.
03.07. PZR’ın Başlıca Kullanım Alanları
PZR’ın hekimlikte bir çok kullanım alanı bulunmakta ve kontrollü çalışmalarda güvenilir, çabuk, spesifik ve sensitif olması nedeniyle de tercih edilmektedir.
1) Mikrobiyolojik çalışmalarda PZR: Rutin klinik muayenelerde hastalık ajanlarının izolasyon ve identifikasyonları oldukça zaman almakta ve bazen de herhangi bir etken ayrılamamaktadır. Serolojik yoklamalar da, şüpheli veya negatif sonuçlar verdiği gibi yanlış negatif ve pozitif reaksiyonlar da elde edilebilmektedir. Bunun gibi olgularda PZR büyük kolaylıklar sağlamaktadır. Her ne kadar PZR direkt teşhis yöntemi olmamakla beraber, amplifikasyondan sonra işaretli probların kullanılması veya elektroforezisden sonra oluşan kanıtların boyanarak (ethidium bromidle) görüntülenmesi, tanıyı kolay hale getirmektedir. PZR’’n başlıca kullanıldığı durumlar aşağıda kısaca belirtilmiştir.
a) Kültürü yapılması, izolasyonu ve identifikasyonu çok zor veya yapılamayan mikroorganizmaların teşhisinde,
b) Toksin oluşturan ajanların, saptanması güç olan toksinlerin ortaya konulmasında,
c) Antimikrobial ilaçlara karşı dirençli olan bakterilerin belirlenmesinde,
d) Mikroorganizmalar içinde alt tiplerin saptanmasında,
e) Gıdalarda, sularda ve yiyeceklerde bulunan mikroorganizmaların tanısında,
f) Diğer mikrobiyolojik araştırmalarda (moleküler immunoloji ve epidemiyoloji, parazitoloji, bakteriyoloji, viroloji, vs.) PZR’dan büyük yararlar sağlanmaktadır.
2) Adli tıp: DNA fingerprintleri cinayetlerin aydınlatılmasında büyük yardımlar sağlamaktadır. Babalık tayini ve HLA (histokompatibilite antijenleri) testleri PZR ile çok kolaylaşmış bulunmaktadır. Cinayet olgularında çok az bir kan, çok az saç veya sperma test için yeterli olabilmektedir. Böyle olgularda, PZR güvenilir ve çabuk sonuçlar vermektedir.
3) Genetik bozuklukların belirlenmesinde: Canlılarda genetik karakter gösteren bozuklukların belirlenmesinde de aynı etkinlikte kullanılmaktadır.
04. Polimeraz Zincir Reaksiyonunun (PZR) Modifikasyonları
Yukarıda açıklanan ve çok yararlanılan konvansiyonel polimeraz zincir reaksiyonunun bir çok modifikasyonları yapılmıştır. Bunlardan önemli bazılarının çok kısa olarak çalışma mekanizmaları aşağıda bildirilmiştir.
1) İnvers (tersine dönmüş) polimeraz zincir reaksiyonu
2) Asimetrik polimeraz zincir reaksiyonu
3) Homopolimerli polimeraz zincir reaksiyonu
4) İn situ polimeraz zincir reaksiyonu
5) Hot start polimeraz zincir reaksiyonu
6) Multipleks polimeraz zincir reaksiyonu
7) Kantitatif polimeraz zincir reaksiyonu
8) Nested polimeraz zincir reaksiyonu
9) RNA’nın amplifikasyonu
04.01. İnvers (tersine dönmüş) Polimeraz Zincir Reaksiyonu
Bu teknik, bilinen sekanslara bitişik olarak bulunan ve fakat bilinmeyen bazlara sahip olan DNA segmentlerini amplifiye etmede kullanılır. Bilinmeyen sekanslar, tersine çevrilerek içe alındığı için bu adla tanımlanmaktadır.
İnvers PZR yandaki şekilde gösterilmektedir. | 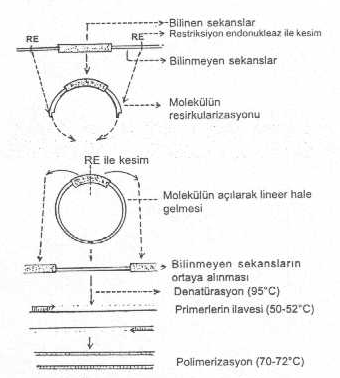
|
1) Bilinen sekansın iki ucunda bulunan ve baz sıraları bilinmeyen segmentler belli bir uzaklıktan restriksiyon endonukleaz ile kesilir ve iki tarafta yapışkan uçlar meydana getirilir.
2) Bu kesim sonucunda molekül lineer bir forma gelir.
3) İki yapışkan uç birleştirilerek molekül sirküler şekle dönüştürülür.
4) Ortada bulunan ve bilinen sekanslara sahip olan DNA segmenti, ortasından başka bir restriksiyon endonukleaz ile bölünerek molekül tekrar lineer bir forma getirilir. Bu molekülün iki ucunda bilinen sekanslar bulunmaktadır.
5) Bu iki uçta bulunan bilinen sekanslara komplementer olan iki ayrı primer hazırlanarak reaksiyon ortamına katılır. Ayrıca, Taq polimeraz ve polimerizasyon için gerekli olan 4 tür dNTP (dATP, dGTP, dCTP, dTTP) de ilave edilir.
6) Geri kalan işlem konvansiyonel PZR’daki prosedüre uyularak devam ettirilir. Böylece, bilinmeyen sekanslara cDNA sentezlenmiş ve bunların baz sıraları da belirlenmiş olur.
04.02. Asimetrik Polimeraz Zincir Reaksiyonu
Hedef DNA’nın sadece bir iplikçiğinin amplifikasyonuna yönelik ve farklı oranda (1:50) primerler kullanılarak yapılan bir polimeraz zincir reaksiyonudur. Asimetrik PZR iki aşamada gerçekleştirilir. Reaksiyonda az sayıda olan primerler kullanıldıktan sonra, çok sayıda olan diğer primerler tek iplikçik DNA zincirinin sentezini başlatır ve çoğaltır.
Asimetrik PZR yandaki şekilde gösterilmektedir. | 
|
04.03. Homopolimerli Polimeraz Zincir Reaksiyonu
Bu reaksiyon, primer bağlanma bölgesi olarak yalnız bir sekansın bilindiği durumlarda uygulanmakladır. Bu bilinen bölgeye primerler bağlanırlar. Bu yöntemde, mRNA molekülü revers transkriptaz enzimi ile komplementer DNA (cDNA) haline dönüştürülür. Elde edilen tek iplik DNA molekülünün 3'-terminusuna poli G’ler bağlanır. Bu uçlara bağlanabilmesi için 5'-terminusunda poli C’ler bulunan primerler hazırlanır ve reaksiyona iştirak ettirilerek tek iplikçik cDNA’ya ikinci bir DNA sentezlenir. Sonra bu iki DNA ayrılarak her birine spesifik primerler kullanılarak amplifiye edilirler.
04.04. İn Situ Polimeraz Zincir Reaksiyonu
Bu tekniğin esasını, morfolojik olarak sağlam hücre ve dokuların DNA’sının amplifikasyonu oluşturur. Bu yöntem, daha ziyade, parafinlenmiş veya arşiv dokuları için geliştirilmiştir. Bir lâm üzerinde tespit edilmiş ve morfolojik olarak sağlam hücre veya doku örnekleri hedef DNA (veya mRNA) kaynağı olarak kullanılır. Lâm üzerine, proteaz solüsyonu ilave edilerek dokulardaki proteinler giderilir ve %0.5 Nonidet P40’la da permeabilitesi artırılır. Sonra üzerine amplifikasyonda gerekli olan komponentler (primerler, 4 tür dNTP, MgCl, ve diğer solüsyonlar) konur ve üzerine bir lâmel kapatıldıktan sonra kenarları yapışkan bir madde (veya tırnak cilası) ile sabitleştirilir. Bu aşamadan sonra, lâm alüminyum bir kaba konarak Thermal cyclere yerleştirilir. Ortama 60°C’de Taq polimeraz ve mineral yağ ilave edilerek lâmel hemen kaldırılır. Sonraki işlemler, konvansiyonel PZR da olduğu gibidir.
Amplifiye olmuş ürünlerin spesifik olup olmadıklarını saptamada nonradioaklif maddelerle (biotin, digoxigenin, vs.) işaretli problardan yararlanılır.
04.05. Hot Start Polimeraz Zincir Reaksiyonu
Konvansiyonel PZR yöntemlerinde kullanılan komponentler (hedef DNA, primerler, Taq polimeraz, MgCl2, dNTP, bufferler, vs.) oda ısısında ve birlikte tüplere konarak aynı anda reaksiyona sokulurlar. Ancak, bu tarzdaki uygulamada, primerler, reaksiyon başlamadan önce oda sıcaklığında Taq polimerazın etkisi altında, hedef DNA dışındaki bazı nonspesifik sekansları da amplifiye etmekte ve böylece yanlış pozitif reaksiyonlara yol açmaktadır. Bazı durumlarda da primer oligomerizasyonu, primer kaybı, nonspesifik amplifikasyonlar, vs. meydana gelebilmektedir. Bu olumsuz durumlara mâni olmak için geliştirilen Hot Start PZR’da reaksiyona giren maddelerin bir kısmı (primerler, dNTP, MgCl2, buffer) oda sıcaklığında tüplere konulmakta, sonra bunların üzerine buharlaşma ile madde kaybını önlemek için mineral yağ (manuel sistemde) veya balmumu tableti (otomatik sistemde) eklenmektedir. Geri kalan komponentler (Taq polimeraz, hedef DNA, buffer) de optimal ısı olan 60-80°C arasında reaksiyon tüpüne katılırlar. Bundan sonraki aşamalar konvansiyonel sistemdeki gibidir.
04.06. Multipleks Polimeraz Zincir Reaksiyonu
Bu teknik, aynı amplifikasyon reaksiyonunda, farklı hedef DNA sekanslarına yönelik hazırlanan spesifik multiple primer çiftlerinin kullanılması ile gerçekleştirilir. Değişik hedef sekanslarının koamplifıkasyonu bir çok amaç için kullanılma olanağı bulunmaktadır. Şöyle ki,
a) DNA sekanslarının büyük bir bölümü, bunlarda bulunması muhtemel alterasyonlar yönünden incelenebilirler.
b) Hedef DNA’nın farklı segmentleri araştırılabilir,
c) Sekansların amplifiye olabilirliğinin internal kontrolleri yapılabilir
d) Bir numunede bulunan değişik ajanlara ait DNA’lar aynı tüpte aynı anda amplifiye edilebilirler.
Bu test, S. aureus ve C. difficile ’de denenmiştir.
04.07. Kantitatif Polimeraz Zincir Reaksiyonu
Konvansiyonel PZR, genellikle, kalitatif bir karakter taşır. Diğer bir ifade ile amplifikasyon var veya yok sorusuna cevap verebilmektedir. Halbuki, son yıllarda geliştirilen yeni PZR teknikleri ile amplifiye olan hedef DNA’nın miktarı hakkında da bir bilgi verebilecek düzeye ulaşılmıştır. Bu yöntem, reaksiyona başlangıçta konulan hedef DNA miktarı ile, PZR sonunda saptanan ürünün düzeyi arasındaki lineer korelasyonun bulunup-bulunmadığını ortaya koymaktadır.
04.08. Nested Polimeraz Zincir Reaksiyonu
İki aşamalı olan bu testte, birinci periyodda, amplifikasyon tek primer çifti ile 15-30 kez tekrarlanır. Oluşan ve sayısal olarak artan ürünler, yeni bir reaksiyon tüpüne transfer edilerek burada, internal sekanslara spesifik sekonder primer çiftleri kullanılarak ikinci bir amplifikasyona tabi tutulur. Bu ikinci defa da 15-30 kez tekrarlanır ve oluşan ürünler jel elektroforezle ortaya konulurlar.
Bu yöntemin avantajları yanı sıra dezavantajları da (özellikle, transfer sırasında meydana gelen kontaminasyonlar, vs.) bulunmaktadır. Bu nedenle iki tüp yerine, tek tüp kullanmak suretiyle kontaminasyon riski minimal düzeye indirilmiştir. Bu tek tüp sisteminde, özellikle, iki tür reaksiyon ısısı kullanılmaktadır (düşük ve yüksek ısı).
[1] Kaynak: Temel Mikrobiyoloji