Virusların Ölçülmesi
Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji1
01. Genel Bilgiler
02. İnfeksiyöz Ünitenin Belirlenmesi
03. Virus Partiküllerinin Sayımı
04. Hemaglutinasyon (HA)
04.01. HA'da Dikkat Edilecek Noktalar
05. Hemaglutinasyon İnhibisyon (HI) Testi
05.01. HI Testinde Dikkat Edilecek Noktalar
06. İndirekt Hemaglutinasyon (İHA) Testi
01. Genel Bilgiler
Viruslar canlı sistemlerde (doku kültürü, embriyolu yumurtalar, deneme hayvanları) üredikleri için ölçülmelerinde yine böyle ortamlarda çoğaltılan virusların suspansiyonları kullanılır.
Virusların ölçülmesi başlıca iki tarzda yapılabilmektedir. Bunlar da,
1) İnfeksiyöz ünitenin belirlenmesi
2) Total sayının saptanması (partikül sayısı)
02. İnfeksiyöz Ünitenin Belirlenmesi
Bu ölçme sisteminde virus suspansiyonun belli bir hacminde (0,05, 0.1, 0.5 veya 1.0 ml) bulunan infeksiyöz ünite veya letal doz (infeksiyon, letal etki, CPE, pok, fokus vs. oluşturabilen birim) saptanır. Bu ünite aynı zamanda virusun titresini ve dozunu belirlemede de yardımcı olur.
İnfeksiyöz ünite bir kaç tarzda ortaya konabilir. Şöyle ki,
1) %50 son noktasını saptanması: Virus suspansiyonunun 2-5 veya 10 katlı dilusyonları yapılarak, bunların her birinden (veya kritik 4-5 son dilusyonlarından) canlı sistemlerden en uygun olanına (3,4 veya 5 tanesi) her dilusyondan 0,05 ml, 0.1 veya 0.2 ml miktarında inokule edilir. Belli bir süreden itibaren oluşan ölümler (infeksiyonlar, CPE’ler) incelenirler. Dilusyonlara göre pozitif reaksiyonlar kaydedilerek %50 son nokta saptanır. Bunu belirlemede Reed-Muench ve Kaerber yöntemlerinden oldukça fazla yararlanılır. Bu ikisinden ayrı olarak ve fakat ölümlere göre değil de canlı kalanlara göre de değerlendirme yöntemleri bulunmaktadır. Bunlardan birisi de Sperman-Kaerber metodudur.
Reed-Muench, ve Kaerber yöntemlerinin kullanılması hakkında “Virusların İnfektif Titrelerinin Tayini" kısmında (No.52) örneklere dayalı açıklama yapılmaktadır.
2) Plak formasyonunun saptanması: Hücrelerde üreyerek plaklar oluşturan virusların bu özelliklerinin (plak formasyon ünitesi, pfu) belirlenmesi ve belli inokulumlardaki %50 pfu’nin saptanması mümkündür.
Bu yöntemde, virus sulandırıldıktan sonra kritik birkaç dilusyonundan, doku kültürü şişelerinde monolayer oluşturmuş hücrelerin üzerine, şişelerin büyüklüğüne göre 0.1, 0.2 veya 0.5 ml. miktarında ekilerek uygun bir süre (30-45 dakika) ve 37°C'de inkubasyona bırakılır.Sonra, içerlerinden viruslu sıvı çıkartılır, gerekirse yıkanır ve hücrelerin yüzeyi besleyici agar ile kaplanarak, şişeler tersine (agar üstte olacak tarzda) çevrilerek etüve yerleştirilir. Belli bir süre sonra, agarın altındaki hücrelerde virusun oluşturduğu dejenerasyon odakları (plaklar) sayılır ve plak formasyon ünitesi (pfu) belirlenir.
Plaklar aynı zamanda, genetik saf virus partikülleri elde etmede de yardımcı olurlar. Belli morfolojik özelliklere sahip plaklar seçilerek içlerindeki virus izole edilir ve üretilerek saf virus partikülleri elde edilir (plak pürifikasyonu). Böyle viruslardan aşı elde etmede de yararlanılır (klon aşılar). Ancak bu tür aşılara karşı oluşan antikorların nötralizasyon spektrumu oldukça dardır.
Her bir plak, bir tek virus partikülünden ziyade birden fazla virusun (infeksiyoz ünite) oluşturduğu bir infeksiyon odağıdır. Bu nedenle de plak formasyon ünitesi olarak adlandırılır. Ancak, çiçek viruslarında bir virionun bir odak oluşturabileceği de belirtilmektedir.
Plak formasyon ünitesinin saptamak kolay olmakla beraber, bütün virusların plak oluşturmaması nedeniyle kullanım alanı sınırlıdır.
Plakları iyice görebilmek için, agar üzerine nötral red boyası solüsyonu konarak canlı hücrelerin boyanması sağlanır. Ölü olanlar ise boyanmaz ve solgun olarak görülürler.
Plakların büyüklüğü ve şekli virus türlerine ve kullanılan hücre tiplerine göre değişebilir.
3) Pok formasyonu: Bu test, daha ziyade çiçek viruslarının, embriyolu yumurtaların korioallantoik membranı (CAM) üzerinde ürediklerinde meydana getirdikleri odakları (çiçek lezyonları, pok) belirlemede ve saymada kullanılır. Uygulaması diğerlerine göre daha kolaydır. Ancak, yumurtalar arasında farkın olması pok oluşumuna etkiler.
CAM üzerindeki poklar, genellikle, opak, beyaz veya kırmızı lekeler halinde görülebilir.
Virusların poklara göre titrasyonları bu plakların sayımı ile elde edilir. Burada da poklar birden fazla sayıdaki virus partiküllerinden meydana gelir (pock forming ünite, pfu).
4) Fokus formasyonu: Bazı tümör virusları üredikleri hücrelerde dejenerasyonlar (CPE) ve plaklar oluşturmazlar.
Ancak, hücrelerde, bazı fokal morfolojik değişiklikler (fokus) meydana getirirler ki, bunlar gözle veya küçük büyütme ile kolayca görülebilirler.
Böyle odaklar sayılarak fokus forming ünite (ffu) olarak titre hesaplanır.
03. Virus Partiküllerinin Sayımı
Virus partiküllerin sayımı yapılarak suspansiyon içindeki miktarını yaklaşık olarak bulmak mümkündür. Ancak, bu partiküllerin hepsinin, olgun olduğunu veya canlı da düşünmemek gerekir. Çünkü, bazı virusların morfolojik olarak sağlam görünmesine rağmen defektif olabilmektedir. Dolayısıyla da infektif olanlar ile olmayanlar belirlenemezler.
Virus partiküllerinin sayılmasında yararlanılan teknikler kısaca şöyledir,
1) Elektron mikroskopla sayım: Bu teknikle başlıca 2 yöntem bulunmaktadır. Bunlardan biri, bilinen boyutlara sahip olan lateks partiküllerine virus adsorbe edilerek, grid üzerine yayılır ve elektronmikroskop altında latekse bağlanmış olan virus partikülleri sayılır. Lateksin yoğunluğu bilindiğinden, virusunki de buna göre saptanır.
İkinci yöntem ise, suspansiyondaki virus partikülleri grid üzerine santrifugasyonla çöktürülerek elektron mikroskop altında sayılır ve böylece partikül sayısı hesaplanır.
2) Optikal dansitenin hesaplanması:Bu yöntemle bazı virusların suspansiyon içindeki partikül sayısı belirlenmiştir. Örn., reovirusların, 260 nm dalga uzunluğunda, 1 optikal dansitedeki (OD) miktarının 1 ml de 2,1x1012 virus partikülü ve çiçek virusunda 1,2x1010 virus partikülü olduğu saptanmıştır.
3) Hemaglutinasyon testi: Bu test, insan ve çeşitli hayvanların alyuvarlarını aglutine etme özelliği olan viruslarda kullanılan pratik bir yöntemdir. Burada virusun partikül sayısından ziyade, alyuvarları aglutine edebilen hemaglutinasyon ünitesi (HAÜ) hesaplanarak, virus suspansiyonundaki, HA ünitesi ve virusun titresi belirlenir.
04. Hemaglutinasyon (HA)
İnsan ve çeşitli hayvanların eritrositleri, bazı bakteri veya viruslarla birlikte bulundukları zaman bir kümeleşme gösterirler ki, bu fenomene kanın aglütinasyonu anlamına gelen hemaglutinasyon (HA) adı verilmektedir. Bu olgu, in vitro koşullarda, mikroorganizmalar tarafından alyuvarların direkt aglütinasyonu olduğundan da direkt hemaglutinasyon (direkt HA) olarak ta tanımlanmaktadır, Bu reaksiyon, serumun fonksiyonu olmadığından, bir serolojik, fenomen değildir. Buna karşın, indirekt HA, serolojik bir reaksiyondur.
Bakterilerce meydana getirilen direkt HA’da,mikroorganizmaların etrafında bulunan pilusların (fimbria) önemli rolleri vardır. Bu strüktürler, aynı zamanda, bakterilerin çeşitli hücrelere tutunmasında ve bağlanmasında da etkin görev yaptığından, mikropların kolonizasyonunda ve hastalık oluşturmalarında fonksiyonları vardır. Bu nedenle, fimbrialar, virulens faktörleri arasında önemli bir yere sahiptirler. Fimbrialar bakterilerin etrafın da, genellikle, peritrik olarak ve çok sayıda (100-500) lokalize olmuşlardır. Böyle bakterilere, enterobakteriler, streptokoklar, korinebakteriler, klostridiumlar, vs örnek olarak verilebilirler.
Bir kısım bakterilerin etrafında pilus bulunmasına karşın hemaglutinasyon gösterebilirler. Bu nedenle de hemaglutinasyon reaksiyonu, pilusu ortaya koymada tek başına bir kriter olarak düşünülmemelidir.Bazı bakterilerde de pilus formasyonuna rastlanmamasına karşın, yüzeylerinde bulunan özel ligandların (kimyasal moleküller) alyuvarların yüzeyindeki reseptörlere bağlanması sonu yine de direkt HA meydana gelebilmektedir. Örn, M. gallisepticum S 6 suşu kanatlı alyuvarlarını aglutine eder. Bu grupta bulunan mikroorganizmaların hücre duvarları bile bulunmamaktadır (Mycoplasmalar).
Kapsüllü bakteriler (B. anthracis, P. multocida, C. welchii, vs), genellikle, direkt hemaglutinasyon oluşturmazlar.
Bakterilerdeki direkt HA fenomeni, biri mannoza duyarlı (mannose sensitive) HA ve diğeri de mannoza dirençli (mannose rezistense) HA olmak üzere iki karakter göstermektedir ve bu kritere göre de sınıflanmaktadırlar.
Bakterilerin yanı sıra, direkt HA olgusuna, bazı virus familyalarında da (özellikle, orthomyxoviridae, paramyxoviridae, poxviridae, adenoviridae, arboviridae, vs) rastlanmaktadır.Orthomyxoviridae ve paramyxoviridae grubuna ait viruslarda, zarfın dışında bulunan ve peplomer olarak adlandırılan oluşumlardan hemaglutininlerin, bazı canlıların (insan ve çeşitli hayvan) alyuvarlarını aglutine etmede rolleri fazlaca bulunmaktadır. Bu tür hemaglutininler viral zarfın yüzeyinde çıkıntılar halinde (spike) ve homojen olarak dağılmış bir durumda bulunurlar. Poxviruslarında ise, hemaglutinasyona, viral partikülden ayrılabilen daha küçük üniteler neden olmaktadırlar. Diğer viruslarda da bunlara benzer strüktürler direkt HA olgusunda etkindirler. Kanatlılarda infeksiyöz bronşitise yol açan I.bronchitis virusu, eğer fosfolipaz C ile muamele edilirse, direkt HA gösterebilir.
Gerek bakterilerde ve gerekse viruslarda (myxoviruslarda) hemaglutinasyonun mekanizması kısaca aşağıda bildirilmiştir.
Bakterilerin yüzeylerinde bulunan fimbrialar (veya özel moleküller, ligandlar) ile alyuvarlar arasında bir bağ kurulmasına ve alyuvarların yan yana gelmesine yol açarlar. Myxoviruslarda da bu görevi hemaglutininler üstlenir ve alyuvarların birbirlerine bağlanmasında etkin rol oynarlar. Bu durum aşağıdaki şekillerde gösterilmiştir.
Direkt hemaglutinasyon testi yandaki şekilde gösterilmektedir. | 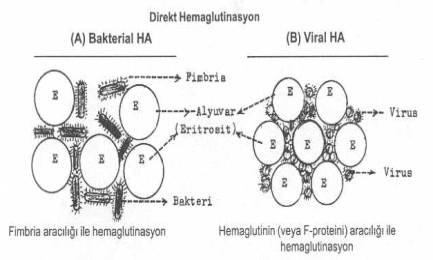
|
Orthomyxoviruslar ve paramyxoviruslarında hemaglutinasyon meydana geldikten, yaklaşık 45-60 dk sonra, alyuvarlar birbirlerinden ayrılır ve kümeler dağılır (elusyon). Bu olguda da, yine zarfın yüzeyinde bulunan diğer bir tür peplomer olan neuraminidasenın (sialidase) enzimatik aktivitesinin etkinliği bulunmaktadır. Bu enzim, alyuvarların yüzeylerinde bulunan, glikoprotein ve glikolipidlerin yapısındaki, oligosakkarid zincirinin ucundaki galactose-N-acetylneuraminic acidi (sialik asit) ayrıştırarak bu maddenin serbest kalmasına ve dolayısıyla de bunlara bağlanmış olan alyuvarların da çözülmesine neden olurlar. Serbest kalan alyuvarlar, aynı virusla tekrar aglütinasyon gösteremezler. Çünkü, bunlara ait alyuvar yüzeyindeki reseptörler tahrip olmuştur. Ancak, başka viruslarla hemaglutinasyon meydana gelebilir.
Eğer alyuvarlar, bir reseptör tahrip eden enzime sahip olan V. cholera filtratı ile muamele edilirse, hemaglutinasyon meydana gelemez. Çünkü, filtrattaki enzim alyuvarların yüzeylerindeki reseptörleri parçalar (RDE, receptor destroying enzyme).
Poxviruslarında, hemaglutinasyon daha farklı şekilde meydana gelir. Bu virus grubunda, hemaglutininler, esas virus partikülünden ayrılabilir ve ayrı olarak elde edilebilirler. Bunlar esas virus partiküllerinden daha küçük ve fosfolipid karakteri taşımaktadırlar. Reovirus, adenovirus ve arboviruslarında, HA’ya, virus partiküllerinin bizzat kendileri neden olurlar.
Direkt HA testi, ya lâm üzerinde çabuk HA testi veya tüplerde (veya mikropleytlerde) yavaş HA testi olarak yapılır. Yavaş HA testi de, makro ve mikro hemaglutinasyon reaksiyonu tarzında uygulanabilmektedir. Son yıllarda, zaman ve ekonomi sağlaması bakımından mikrotestler daha fazla kullanılmaktadır. Her iki tekniğin amacı arasında biraz fark bulunmaktadır. Şöyle ki, çabuk HA testinde, allantoik sıvı veya doku kültürü sıvısında, HA veren virusun varlığının aranmasına karşın yavaş HA testinde ise, HA veren virusun konsantrasyonu veya titresi hesaplanır. Bu nedenle virusun teşhisinde çabuk HA testi daha etkindir.
Aşağıda Newcastle virusunun teşhisinde çok kullanılan HA testlerinden bahsedilecektir.
Çabuk HA testi : Bir hastalık olgusundan (örneğin, Newcastle hastalığı) alınan patolojik materyallerden usulüne uygun olarak hazırlanan inokulumlar, 8-10 günlük embriyolu yumurtaların korioallantoik boşluğuna şırınga edildikten sonra 2.günden itibaren ölen embriyoların allantoik sıvıları toplanır ve bunlardan bir damla temiz bir lâm üzerinde, bir damla kan ile (örn. tavuk kanı %5-10) karıştırılırsa 2-3 dk. içinde alyuvarların kümeleşmesi, HA gösteren bir virusun varlığını ortaya koyar (HA pozitif). Bu nedenle de virusun teşhisine yardımcı olur. Eğer başka bir virus varsa (HA göstermeyen) veya hiç bir virus yoksa, HA meydana gelmez ve alyuvarlar homojen bir dağılım gösterirler (HA negatif). Test oda ısısında yapılır.
Yavaş HA testi: Bu test hemaglutinasyon gösteren virusun konsantrasyonunu (veya yoğunluğunu) ortaya koyar. Reaksiyon, virusun sulandırılmaları ile yapıldığından, virusun HA titresini ve HA ünitesini belirler. Allantoik sıvıda az virus varsa, HA titresi üç-beş sulandırmadan ileri gitmemesine karşın çok virusun bulunduğu durumlarda HA titresi l/2048 ve daha ileri dilusyonlara kadar gidebilir. Bu durum, virus yüzeyindeki hemaglutininlerin (peplomer) ve hücre yüzeyindeki spesifik reseptörlerin sayısı ile yakından alakalı, olduğu kadar embriyoda üreyen olgun virus miktarı ile de ilişkilidir. Çok virulent viruslar, uzun süre üreme fırsatı bulamadan embriyoları öldürmesine karşın, zayıf virulentli olanlar daha uzun zaman ürerler ve bunların titreleri de çok yüksek olur.
Yavaş HA testi, virusun ölçülmesinde yardımcı olduğundan, çok dikkatle uygulanması gereklidir. Özellikle, virusun sulandırması yapılırken, bir tüpten diğerine fazla miktarda virus transferi, titrenin yükselmesine yol açar ki bu da yanlış sonuçlara vardırır.
HA testinde, pozitif reaksiyonlarda tüplerin dibinde dantela gibi (genişçe) alyuvar birikintisi meydana gelmesine karşın, negatif olgularda ise dipte (ortasında) düğme tarzında bir alyuvar toplanması olur. Pozitif reaksiyonun görüldüğü son tüp 1 HA ünitesi olarak kabul edilir (Yorum: Virus, bu dilusyonunda (Örn,l/64) kullanılan 0,25 ml.sinde bir tane HA ünitesine sahiptir). Bu, virusun hiç sulandırılmamış olan yoğun suspansiyonunda ise, 0,25 ml miktarında, 64 HA ünitesi bulunduğunu ifade eder.
Yavaş HA testi ve değerlendirilmesi yandaki şekilde gösterilmektedir. | 
|
Oda ısısında test yapılır. Virus, genellikle, 2 katlı olarak (1/2, 1/4, 1/8 ® veya l/5, 1/10, 1/20, 1/40 ®) sulandırılır. Her sulandırmadan alınan belli bir miktar (0,25 ml) tüplere konur ve üzerine yine aynı miktar %1 (veya %0.05) sulandırılmış alyuvardan ilave edilerek çalkalanır ve oda ısısında 45-60 dk. tutulur. Bundan sonra değerlendirme yapılır. Hemaglutinasyon görülen son dilusyon (bu testte 1/64) 1 HA ünitesi olarak kabul edilir ve virusun HA titresi olarak değerlendirilir.
Testin hazırlanışında araştırıcılar yönünden bazı farklar bulunabilir. Bunların virusun ve kullanılan alyuvarların özelliğinden kaynaklanmaktadır. Önemli olan nokta, HA ünitesi, bir serolojik reaksiyon olan HI (Hemaglutinasyon inhibisyon) testinde kullanıldığından, virus ve alyuvarlara ilaveten reaksiyona bir de serumlar girmekte ve hacim biraz artmaktadır. Bu dezavantajı gidermek için, HA testi yaparken virus sulandırılması üzerine belli miktar da fiz. su ilave edilerek, total hacim HI testindeki düzeye getirilir. Örn. tüplerdeki virus miktarı 0,25 ml olsun, bunun üzerine 0,25 ml fiz. su ilave edildikten sonra 0,25 ml kadarda alyuvar ilave edilir. Böylece toplam 0,75 ml olur. HA titresi de bu hacme göre belirlenir. HI testinde ise, 0,25 ml virus + 0,25 ml serum + 0,25 ml alyuvar kullanılarak total hacim 0,75 ml olur. Böylece miktar olarak her iki test aynı olmuş olur.
Yavaş HA testi, miktarlar 1/10 oranında azalmak suretiyle mikro hemaglutinasyon tarzında uygulanabilir ve sonuçlar aynı tarzda ve gözle değerlendirilir. Bu test için, mikropleytler, multikanal pipet ve pipet başlıkları, vs. kullanılır.
04.01. HA'da Dikkat Edilecek Noktalar
1) Test oda ısısında yapılmalı (20-25°C),
2) Sulandırmalarda kullanılacak Fiz. su, camdan çekilmiş distile sudan hazırlanmalı,
3) Distile suya katılan tuz (NaCl), çok iyi kalitede olmalı, fizyolojik tuzlu su, hemoliz veya hemaglutinasyon oluşturmamalı,
4) Tüp, pipet, lam ve mikropleytler çok temiz olmalı (zararlı madde, deterjan, içermemeli),
5) Alyuvarlar fiz su ile 3 kez iyice yıkanmalı, hemoliz göstermemeli, antikor taşımamalı,
6) Virus sulandırılırken, pipetle, fazla virus bir sonraki dilusyona aktarılmamalı, mümkünse her dilusyon için mikropipet başlığı veya pipet değiştirmeli,
7) Pipetleri, dilusyonlara çok daldırmamalı, pipetlerin dış yanlardan tüplere fazla virusun kaçması önlenmeli,
8) Virus dilusyonlarına fiz. su ve alyuvarlar ilave edildikten sonra tüpler veya pleytler iyice karıştırılmalı,
9) Alyuvarlar hep aynı (eşit) miktarda ilave edilmeli,
10) virus sulandırması çok dikkatli yapılmalı, tüp veya pleytlerde eşit miktarda virus solusyonu bulunmalı,
11) Sonuçların okunması 45-60 dk. arasında yapılmalı, fazla geç kalınmamalı,
12) Test edilecek virus suspansiyonu mümkün olduğu kadar berrak olmalı (embriyolu yumurtalardan allantoik sıvıya içine kan, albumin, yumurta sarısı, doku parçaları, vs.) karışmamalı,
13) HA titresini tam olarak saptamak için, HA testi 2 seri tüpte yapılmalı, buna göre HA ünitesi kesin belirlenmeli,
14) Yavaş HA testinde bir tane de fiz. su kontrolü bırakılmalı (bu tüpte hemoliz veya hemaglutinasyon görülmemeli),
15) Virus genellikle 2 katlı sulandırılır (1/2, 1/4, 1/8, 1/16 ® veya 1/5, 1/10, 1/20, 1/40®). Ancak, birinci tarz sulandırma log2 ye göre kolayca değerlendirilebilir. Şöyle ki; 1/2 = log2 21 ; 1/4 = log2 22; 1/8 = log2 23, vs. Halbuki ikinci sulandırma log 10 tabanına göre değerlendirilir. 1/5 = log10 100.632 ; 1/10 = log10 10-1.000, 1/20 = log10 10-1.320 vs)
16) Tam hemaglutinasyonun görüldüğü son tüp (veya pleyt çukuru) 1 HA ünitesi veya virusun hemaglutinasyon titresi olarak dikkate alınır,
17) Fizyolojik su yerine, pH'sı 7,2'ye ayarlanmış buffer solüsyonları da kullanılabilir,
18) Virus ve alyuvar stok suspansiyonları kullanılmadan hemen önce çok iyi karıştırılarak homojeniteleri sağlanmalı.
05. Hemaglutinasyon İnhibisyon (HI) Testi
Bu test, serolojik bir özellik taşır ve kanda antikor varlığını ve antikorun miktarını saptamada kullanılır. Test makro ve mikro HI testi şeklinde genellikle tüplerde veya mikropleytlerde yapılır.
Testin esası kısaca şöyledir. Hastalıktan şüpheli bireylerden alınan serumlar, eğer virusa karşı spesifik antikor taşıyorlarsa, bu antikorlar virusla temasla, virusun HA özelliğini nötralize ederek HA'ya mani olurlar. Tüplerde, dipte, yuvarlak nokta şeklinde (düğme) alyuvar birikintisi olur. Eğer serumda antikor yoksa, virus nötralize olmayacağından, HA kabiliyeti korunacak ve alyuvarları dantela şeklinde kümeleştirecektir. Tüplerin dibinde dantela görünümü oluşacaktır. HI testi değerlendirme bakımından HA'nın tersi bir durum gösterir.
Şöyle ki,
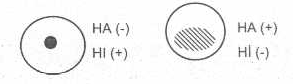
Diğer bir deyimle, HA varsa kanda antikor yok, HA yoksa kanda antikor var demektir.
Serumların HI titreleri de içindeki antikor miktarı ile orantılıdır. Çok fazla antikorun olduğu durumda serumun titresi ileri sulandırmalara kadar ulaşmasına karşın, az antikor varsa serumun HI titresi ilk dilusyonlarda kalabilir.
HI titresi uygulama tarzı kısaca şöyledir (Newcastle hastalığında)
HI testi ve değerlendirilmesi yandaki şekilde gösterilmektedir. | 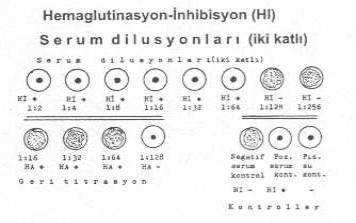
|
1) Serumlar (şüpheli) iki katlı sulandırılır (1/2, 1/4, 1/8 ®),
2) Virus 4 (veya 8) HA ünitesinde sabit tutulur, virusun HA titresi 1/64 olduğundan ve bu dilusyonda virusun 0.25 ml.miktarında 1 HAÜ vardır. Buna göre, virusun 1/16 dilusyonunun 0.25 ml 4 HAÜ bulunur. Virus 1/16 sulandırılarak her tüpe bu dilusyondan 0.25 ml ilave edilir.
3) Alyuvar süspansiyonu (%1 veya %0,5) oranında hazırlanır.
Önce serumlar iki katlı sulandırılarak her sulandırmadan ayrı tüplere 0,25 ml konur. Üzerine 4 (veya 8) HA ünitesinden sabit tutulan virus sulandırmasından 0,25 ml ilave edilir. İyice karıştırılır. Oda ısısında 20 dk. bekletilir. Sonra üzerine %1'lik alyuvar suspansiyonlarından 0,25 ml ilave edilerek karıştırılır. Oda ısısında 45-60 dk. tutulur. Sonuçlar yukarıda açıklandığı tarzda değerlendirilir. Ancak, sonuçları değerlendirmede, inhibisyon görülen son tüpe ait serum dilusyonu, 4HA ünitesi ile çarpılarak serumun inhibisyon titresi bulunur yani inhibisyon noktası 1/64 ise serum inhibisyon titresi 4x1/64=1/256, log21/256 (=2-8) olarak kabul edilir.Virusun 4 (veya 8) HA ünitesinde sabit tutmada bazı hatalar yapıldığından geri titrasyon yapmak ve sabit üniteyi kontrol etmek gereklidir. Geri titrasyon, teste sabit tutularak kullanılan virusun istenilen HA ünitesinde yani 0.25 ml de 4 HA ünitesinde olup olmadığını belirler.
Yukarıdakilere ilaveten HI testinde bir tüp fiz. su kontrolü, bir pozitif ve bir negatif serum kontrolleri kullanılır.
HI testi, sadece infeksiyona yakalanmış (veya kanlarında antikor bulunan veya yakalanmamış (antikor taşımayan) bireyleri değil, aynı zamanda aşılama sonu oluşan bağışıklığın durumunu belirlemede de işe yarar.
HI testinden yararlanılarak, insan veya hayvan topluluklarında (populasyon) aşılamadan sonra oluşan antikorların durumu belirlenerek bağışıklığın ne düzeyde olduğu saptanabilir.
Bir infeksiyona karşı (HA veren viruslarla aşılanan bin bireylik bir populasyondan, rendom sampling (tesadüfi örnekleme) yöntemi ile 32 kan örneği alınarak, çıkarılan serumlar hemen HI testine tabi tutulmuş ve aşağıdaki sonuçlar elde edilmiş olsun, buna göre 1000 bireylik populasyon da oluşan ortalama antikor durumu nedir? Yeterli bağışıklık oluşmuş mudur? Duyarlı olanlar var mı? Oranı nedir? Antikor dağılımı nasıldır? gibi soruların cevapları verilebilir.
05.01. HI Testinde Dikkat Edilecek Noktalar
1) Test, oda ısında yapılmalı ve değerlendirilmelidir,
2) Test yapılmadan hemen önce virusun HA titresi yeniden saptanmalı ve HA ünitesi iyi belirlenmelidir.
3) Virus, bu yeni tireye göre 4 HI ünitesinde (veya 8 HA ünitesinde) sabit tutulmalı. Örn. virusun HA titresi 1/64 ise, 4 HA ünitesi 64/4 = 1/16 eder. Yani, virus 1/16 sulandırıldığında bir inokulum miktarında (0.25 ml) 4 HA ünitesi bulunacak demektir.
4) Virus ve alyuvar stok suspansiyonları kullanılmadan önce homojen olarak ve iyice karıştırılmalıdır.
5) Serum çok dikkatli olarak sulandırılmalı ve kabul edilen metoda göre iki katlı yapılmalı (1/2, 1/4, 1/8, 1/16 ®).
6) Sonuçlar 45-60 dk. içinde okunmalıdır.
7) Negatiflik kriteri: sonuç da, serumların pozitif veya negatif olduğuna karar verirken, daha önceden bir negatiflik kriteri belirlenerek bunun üstündeki değerleri pozitif ve altındakileri negatif olarak kabul etmek daha uygun olur. Hatta, şüpheli serumları ortaya koyabilecek bir ara kriteri de saptanmalıdır. Böylece, sonuçlar negatif, şüpheli ve pozitif olarak 3 kategoride değerlendirilebilirler.
8) Negatiflik kriteri belirlenirken hiç bir hastalık geçirmemiş veya aşılanmamış bireylere ait en az 15-20 serumun titresi saptanarak karar verilir.
9) Geri titrasyon: Ne kadar dikkatli çalışılsa bile, 4 HI ünitesine göre virusu sulandırmada (veya sabit tutmada) çok defa hata yapılmakta ve bir inokulum içinde 4 yerine, 4 den az (<4) ünite isabet etmekte ve buda HI sonuçlarını etkilemektedir. Bunu saptamak için 4 HA ünitesinde (1/16) sabit tutulan stok virus suspansiyonu bu defa 1/16 dan başlamak üzere, ayrı bir seri tüpte (veya pleytte) 1/16, 1/32, 1/64, 1/128'e kadar devam eden bir HA titresi belirlenmesi yapılır. Eğer hemaglutinasyon 1/16 (+) 1/32 (+) ve 1/64 (+)'e kadar pozitif ise, o zaman HI titresinde kullanılan 4 HA ünitesi de doğru olur. Eğer titre 1/32 de kalmışsa, o zaman stok virus suspansiyonu bir inokulumunda da yani 0,25 ml de 4 HA ünitesi yerine 2 HA ünitesi bulunmaktadır. Sonuçların değerlendirilmesi 2 HA ünitesine göre yapılır.
Böyle durumlarla karşılaşmamak için HI testinden hemen önce HA titresini iyi tayin etmeli ve sabit tutulacak virus dilusyonunu da çok dikkatli hazırlamalıdır.
10) Kontroller: Denemede birer tüp(pleyt çukuru) olmak üzere, fiz. su, negatif ve pozitif serum kontrolleri konulur.
11) Bazı hastalıklarda HI testi uygulanırken serumlar pariodat ile muamele edilir.
12) Sulandırmaların kesin-doğru olmaması ve serumlar, sulandırılırken, bir sonraki tüplere fazla antikor transferleri önemli yanlışlıklar meydana getirirler.
06. İndirekt Hemaglutinasyon (İHA) Testi
(PASİF HEMAGLUTİNASYON)
Serolojk bir karakter taşıyan indirekt HA reaksiyonu, bir infeksiyona karşı vücutta oluşan antikorların belirlenmesinde kullanılan önemli bir testtir. Bu fenomende, etkenin direkt HA göstermesine gerek bulunmamaktadır. Reaksiyonun kısaca mekanizması şöyledir: Bakterilerin etrafında bulunan protein, glikoprotein, glikolipoprotein, vs. özelliğindeki antijenik strüktürlerin ekstraksiyonu yapılır. Bu amaçla bir çok yöntemler bulunmaktadır. Araştırıcılar bunlardan birini uygun bularak kullanabilir. Teste, kullanılacak alyuvarlar önce tannik asitle muamele edildikten sonra antijenik substanslarla direk temasa getirilerek, bu maddelerin alyuvarların yüzeyine adsorbe olması sağlanır. Sonra böyle hazırlanan alyuvar suspansiyonu, testin karakterine göre belli oranda sulandırılarak kullanılır.
İndirekt HA testi yandaki şekilde gösterilmektedir. | 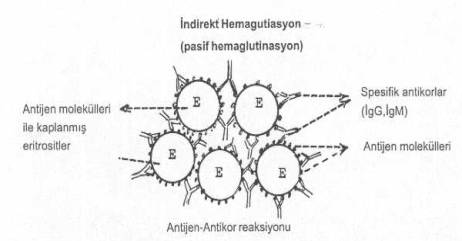
|
Testin yapılışı kısaca şöyledir:
1) Şüpheli serumlar inaktive edildikten sonra iki katlı olarak sulandırılarak tüplere 0.25 ml miktarında konulur.
2) Bunların üzerlerine de antijenle kaplanmış alyuvar solusyonundan ilave edilir.
3) Tüpler iyice karıştırıldıktan sonra reaksiyon oda ısında 3-4 saat sonra gözle değerlendirilir.
a) Tüplerde HA'nın görülmesi kanda antikorların varlığını ortaya koymaktadır (pozitif reaksiyon).
b) Tüplerde HA yoksa, kanda da antikor bulunmuyor demektir (negatif reaksiyon).
c) Testte negatif ve pozitif serum kontrolleri de kullanılır.
Bu test, kullanılan hastalık türüne göre bazı modifikasyonlara sahiptir. Şöyle ki, kullanılan kan türü, tannik asit miktarı, mikroorganizmaların etrafındaki antijenik substansların türü ve elde edilmesi, alyuvarlara adsorbsiyonu, testte kullanılan miktarlar ve değerlendirmeler çok önemlidir ve değişik şekilde yapılabilir. Bazı indirekt HA testlerinde de, şüpheli serumların inaktivasyonları yanı sıra, normal alyuvarlarla da muamele edilerek nonspesifik reaksiyonlar giderilir. Şüpheli serumların sulandırılmaları, bazı testlerde, 1/100 normal tavşan serumlu fizyolojik su içinde yapılmaktadır.
Bu test, araştırıcılara ve hastalığın türüne göre oldukça fazla modifiye edilmiş uygulamalara sahiptir.
[1] Kaynak : Temel Mikrobiyoloji