Prof. Dr. Mustafa Arda
Ankara Üniversitesi Veteriner Fakültesi
Temel Mikrobiyoloji1
01. Giriş
02. Kutan Mikozeslerde
02.01. Potasyum Hidroksit (%10)
02.02. Lacto Phenol Pamuk Mavisi
02.03. Lâm Kültürü Hazırlama
02.04. Rivalier Seydel Yöntemi
02.05. Agar Blok Yöntemi
03. Subkutan ve Sistemik Mikozeslerde
03.01. Muayene Materyallerinden
03.02. Doku Kesitleri Hazırlamak
03.03. Kültürlerden Preparat Hazırlamak
04. Deneme Hayvan İnokulasyonları
04.01. Kutan Mikozesler
04.02. Subkutan ve Sistemik Mikozesler
05. Bazı Besi Yerleri
05.01. Sabouraud Dekstroz Agar
05.02. Sabouraud Glukoz Buyyon
05.03. Littman Oxgall Agar
05.04. Beyin Kalp İnfusyon Agarı
05.05. Mısır Unlu Agar
05.06. Malt Ekstrakt Agar
05.07. Yulaf Unlu Agar
05.08. Patates Dekstroz Agar
05.09. Pirinçli Besi Yeri
05.10. Czapek Agar
05.11. Dermatofit Test Medium ( DTM )
05.12. Cysteinli Kanlı Agar
05.13. Salvin YP Ortam
05.14. Sabhi Agar Besi Yeri
05.15. Casitone Nişasta Agar
05.16. Thioglucolate Besi Yeri
05.17. Nitrat Redüksiyon Ortamı
05.18. Kanlı Agar
06. Diğer Test Ortamları ve Yöntemler
06.01. Kazein Agar
06.02. Peptonlu Su
06.03. Amonyum Nitrat Agarı
06.04. Üre Agar
06.05. Jelatinli Ortam
06.06. Tiamin, İnositol, Nikotinik Asit ve Histidine Gereksinim Testi
06.07. Tyrosine Testi
06.08. Kıl İnvazyon (Perforasyon) Testi (Keratinolizis)
06.09. Germ Tüp Testi
06.10. Dimorfik Mantarların Maya Formuna Dönüştürülmesi
07. Solüsyonlar
07.01. Potasyum Hidroksit ( %10 )
07.02. Parker Boyası + KOH
07.03. Gliserinli Potasyum Hidroksit
07.04. Lakto Phenol Pamuk Mavisi (Aman's Solusyonu)
07.05. Polivinil Alkol Solusyonu
08. Boyalar
08.01. Gram Boyama Yöntemi (Hucker Modifikasyonu)
08.02. Kinyoun'un Boyama Yöntemi
08.03. Ziehl Neelsen Boyama Yöntemi
08.04. Giemsa Boyama Yöntemi
08.05. Periodik Asit Schiff ( PAS ) ile Boyama
08.06. Gridley Boyama Yöntemi
08.07. Akridin Oranj Boyası
09. Antifungal İlaçlar (Antifungal Kemoterapötikler)
01. Giriş
Mantar kolonilerinin makro-ve mikro morfolojilerini kolay ve ayrıntılı inceleyebilmek için önce bunlardan preparatlar hazırlamak ve sonra bu preparatları, ya natif olarak veya uygun boyama yöntemleri ile boyayarak muayene etmek gereklidir. Preparatların hazırlanmasında aşağıdaki tarzda hareket edilir:
02. Kutan Mikozeslerde
Dermatofitozise neden olan mantarların identifikasyonunu sağlamak için preparat, hem laboratuara gönderilen marazi maddelerden ve hem de üremiş olan kolonilerden hazırlanır.
Mikroskopik muayenelerde kullanılacak lâm ve lâmellerin çok iyi temizlenmiş olması, çizgili ve yağlı olmaması gereklidir. Bu amacı gerçekleştirmek için lâmlar devamlı olarak, ağzı iyice kapatılmış ve içinde alkol (% 96) bulunan kaplarda muhafaza edilirler. Kullanılacağı zaman, lâmlar bir pensle tutularak çıkarılır ve alkol kuruduktan sonra yağsız ve tüysüz bir bezle iyice silinir ve alevde hafifçe ısıtılır.
Kolonilerden materyal alırken çok yavaş hareket etmeli ve orijinal morfolojilerini bozmamaya çalışılmalıdır. Materyal, koloniler oluştuktan sonra ve en iyisi olgunlaşma döneminde iken ve koloninin çeşitli yerlerinden alınmalıdır. Mikroskopta iyi bir görünüm elde edebilmek için, uygun bir kontrast sağlanır. Preparat önce küçük büyütme(100-200 x) ve sonra daha yüksek büyütme (450-500 x) ile muayene edilir. Gerekli hallerde immersiyon objektifi de kullanılabilir.
02.01. Potasyum Hidroksit (%10)
Potasyum hidroksit veya Sodyum hidroksit, kıl, tüy, deri ve tırnak kazıntılarını muayenede, materyaldeki debrisleri hidrolize etmek ve materyali berraklaştırmak amacı ile kullanılır. Fungal elementleri iyice görebilmek için, lamdaki preparat hafifçe ısıtılır ve oda ısısında 30-60 dakika bekletilir. Eğer, çok fazla preparat hazırlanacaksa, bu takdirde % 5 KOH veya NaOH solusyonu kullanılır ve preparatlar bir gece bekletildikten sonra mikroskopta muayene edilirler. Preparatlar aşağıdaki tarzda hazırlanır.
1- Temiz ve kuru bir (veya birkaç) lâmın ortasına bir veya iki damla %10 KOH (veya %10 NaOH) solusyonundan damlatılır.
2- Bu solusyonun üzerine, steril bir pensle tutularak alınan yeterince materyalden konur.
3- Lâmelle kapatılır.
4- Alevde çok hafifçe ısıtılır (50oC - 60oC 'de, hiç bir zaman kabarcık çıkmamalı veya kaynatılmamalıdır.)
5- Preparat oda ısısında 30-60 dakika bekletilir. Eğer, alevde ısıtılmış ise, bu süre daha kısa olur.
6- Preparat, önce 100 veya 200 büyütme ile ve sonra da 450-500 büyütme ile muayene edilir.
02.02. Lacto Phenol Pamuk Mavisi
Bu yöntemle muayene, genellikle, kültürlerden yapılır. Solusyonun içindeki laktik asit özellikle mantar elementlerinin muhafazasında, fenol mantarların öldürülmesinde ve pamuk mavisi (anilin mavisi) de boyamada görev alarak iyi bir görünüm sağlarlar.Preparat aşağıdaki tarzda hazırlanır.
1- Temiz ve kuru bir lâmın ortasına bir veya iki damla lacto phenol pamuk mavisi solusyonu damlatılır.
2- Steril iğne ile, koloninin bir kaç yerinden materyal alarak, bu solüsyon üzerine konur.
3- Üzeri temiz bir lâmelle kapatılır.
4- Preparat önce, 100-200 ve sonra da 450-500 büyütme ile mikroskop altında muayene edilir.
Eğer lâmelin etrafı oje ile veya buna benzer madde ile kapatılırsa, uzun, süre muayene olanağı sağlanır. Mikroskopik muayenelerde iyi bir sonuç alınamazsa, o zaman başka bir koloniden materyal alınır. Eski kolonilerde kenarlardan ve genç kolonilerden de orta ve ortaya yakın yerlerden örnek alınarak muayene edilmelidir. İyi bir sonuç alınmadığı hallerde lugol solusyonu veya %10 KOH ile Parker boyası karışımı kullanılabilir.
02.03. Lâm Kültürü Hazırlama
Bu teknik, dermatofitlerin iyi tanınması ve teşhisi yönünden uygulanır. Aynı zamanda, saprofitlerle patojenik mantarların ayrımında da büyük yararlar sağlar. Lâm kültürü aşağıdaki tarzda hazırlanır:
1- Bir tüpte eritilmiş ve 45-50oC 'ler arasına kadar ılıklaştırılmış olan SDA (veya patates dekstroz agar, v.s.) steril temiz bir lâm üzerine ince tabaka şekilde dökülür.
2- Agar içeren lâm, steril boş bir petri kutusunda bulunan (U) veya (V) şeklindeki bir cam borunun üzerine yerleştirilir.
3- Lâm üzerindeki besi yerine, mantar elementlerinden (sporlar, koloni parçaları, miselyum, v.s.) ekilir.
4- Petri kutusunun yanlarına steril distile suya batırılmış pamuk yerleştirilir (veya gliserinli su).
5- Petri kutusunun kapağı kapatılarak uygun ısıda (25°-27°C) ve 4-8 gün inkubasyonda tutulur (koloniler iyice belli oluncaya kadar).
6- Bu sürenin sonunda, kültür kuru bir etüvde 37°C'de 24 saat bırakılır.
7- Lâm, petri kutusundan çıkarılarak, mikroskop altında muayene edilir. Ancak tehlikeli bir mantar üremesinden şüphe edilirse, bu zaman, kültür % 40 formol buharı ile 2 gün muamele edilerek öldürülür ve sonra muayene edilir.
Yukarıda bildirilen lâm kültürü lakto fenol pamuk mavisi ile de boyanarak muayene edilebilir. Bunun için yukarıdaki işlemler aynen uygulandıktan sonra aşağıdaki tarzda hareket edilir.
02.04. Rivalier Seydel Yöntemi
1- Lâm üzerinde koloniler üredikten sonra, agar üzerine, kollodyum 1 ml.+ absolut alkol 2 ml.+ sülfürik eter 2 ml. den oluşan karışımdan kaplayacak miktarda dökülür.
2- Lâm dik tutularak fazla gelen solüsyon aktarılır ve böylece 24 saat bekletilir.
3- Lâm sonra, lakto fenol pamuk mavisi ile 10-15 dakika boyanır.
4- Preparat, %70 alkole daldırılarak fazla boya giderilir.
5- Alkol (% 95’lik) içinde 3-5 saniye dehidre edilir.
6- Aseton (susuz) içine 3-5 saniye daldırılır.
7- Aseton + alkol (1 / 1) veya aseton + toluol (1 / 1) içinde 15 saniye tutulur.
8- Ksilol veya toluol içinde 10 dakika tutulur.
9- Kanada balsamına yatırılır ve mikroskop altında incelenir.
02.05. Agar Blok Yöntemi
Mantarların morfolojilerinin incelenmesinde ve birbirlerinden ayrılmasında çok kullanılan bir yöntemdir.
1- Eritilmiş SDA (veya diğer katı besi yerleri) steril bir petri kutusuna ince bir tabaka (2-3 mm. kalınlıkta) halinde dökülür ve katılaşması beklenir.
Yanda gösterilen tarzda hazırlanır. | 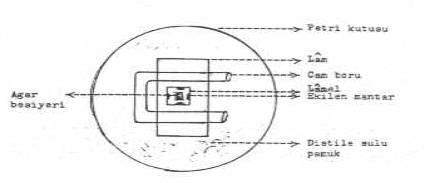
|
2- Üzerinde, steril ve keskin bir bistüri ile 10 X 10 mm. boyutlarında bloklar çizilir.
3- Bunlardan bir tane, steril bir pensle tutularak, steril bir lâmın üzerine ( ortasına ) yerleştirilir.
4- Bu agar içeren lâm, steril petri kutusunda bulunan (U) veya (V) şeklindeki cam borunun (veya cam çubuğun) üzerine yerleştirilir.
5- Agar bloğun kenarlarının orta yerine ekimler yapılır.
6- Agar bloğun üzerine lâmel kapatılır.
7- Petri kutusunun içine, distile suya batırılmış pamuk konur (veya %20 su + %80 gliserin karışımı).
8- Kapak kapatıldıktan sonra, 25-27 °C' de 4-8 gün inkubasyonda tutulur (koloniler iyice görülünceye kadar). Petri kutusu mikroskop altına konarak üreyen mantar kolonileri incelenirler.
9- Bu sürenin sonunda, agar bloğun üzerindeki lâmel bir pensle tutularak kaldırılır.
10-Lâmelin mantarlı yüzü üzerine bir damla % 96'lık alkol konur ve bunun mantar kolonileri üzerine yayılması sağlanır. Tam bir kuruma elde edildikten sonra, lâmel, temiz bir lâm üzerinde bulunan lakto fenol pamuk mavisi solusyonuna, mantarlı yüz alt tarafa gelecek tarzda, yatırılır.
11-Preparat mikroskop altında incelenir (fazla boya solusyonu akıtıldıktan sonra etrafı oje ile kapatılabilir).
Geride kalan agar bloğu, üzerinde lakto fenol pamuk mavisi olan lâm üzerine tersine döndürülerek yatırılır ve üzerine lâmel kapatılır. Preparat mikroskop altında incelenir.
03. Subkutan ve Sistemik Mikozeslerde
Bu mantar infeksiyonlarının teşhisinde, laboratuara gönderilen çeşitli materyallerden ve kültürlerden olmak üzere preparatlar hazırlanır. Bunlarda ya boyamadan veya çeşitli boyama yöntemler ile boyanarak muayene edilirler.
03.01. Muayene Materyallerinden
Laboratuara gönderilen materyallerden (çeşitli eksudatlar, irinler, vücut sıvıları, lezyonlu doku ve organ parçaları, vs.) biri aynen Dermatofitozislerde olduğu gibi, %10 KOH (veya %10 NaOH) ile, diğeri ise, negatif boyama yöntemleri ile (İndia boyası) muayene yapılmak üzere preparatlar hazırlanır ve mikroskop altında incelenir. Bunun yanı sıra, bakteriyolojide kullanılan tekniklere uyularak, preparatlar hazırlanır ve bunlar çeşitli boyama yöntemleri ile (Gram, Giemsa, PAS, Ziehl- Neelsen veya Kinyoun asit -fast boyama tekniği, Methanamine AgNO3, AO “acridin oranje”, vs. boya yöntemleri) boyanarak mikroskop altında immersiyonla muayene edilirler.
03.02. Doku Kesitleri Hazırlamak
Lezyonlu doku parçaları veya biyopsi materyallerinden de, usulüne uygun olarak doku kesitleri yapılır ve bunlar da yukarıda bildirilen boyama yöntemlerinden biri veya ikisi ile ayrı ayrı boyanarak incelenirler. Doku seksiyonlarını boyamada, yukarıdakilerin yanı sıra, Gridley, Musicarmine ve HE boyaları da kullanılabilir.
03.03. Kültürlerden Preparat Hazırlamak
Laboratuara gönderilen patolojik materyaller, şüphelenilen hastalığın karakterine göre bir veya izolasyon şansını artırmak için iki veya daha fazla besi yerlerine, usulüne uygun olarak ekilir. Uygun bir ısı ve inkubasyon süresinden sonra, üreyen mantar kolonilerinden çok dikkatli davranmak kaydıyla, preparatlar hazırlanır ve mikroskop altında incelenir. Kolonilerden hazırlanan preparatlar, duruma göre lakto fenol pamuk mavisi, Giemsa, Ziehl-Neelsen, vs. boyama yöntemleri ile boyanarak mikroskop altında muayene edilirler.
04. Deneme Hayvan İnokulasyonları
Deneme hayvanları, infeksiyon etkeninin özelliğine göre seçilir ve kullanılır. Bu hayvanlara, daha ziyade, teşhis amacı ile inokulasyonlar yapılabilir.
Deneme hayvanlarına, ya infekte materyallerden veya üremiş şüpheli kolonilerden, çeşitli yollarla şırıngalar uygulanır. Deneme hayvanı olarak kobay, tavşan, rat, fare veya bazen de büyük hayvanlar da işe yararlar. Denemelerde eğer mümkünse 2-3 hayvan kullanılmalıdır. Çünkü, mantar infeksiyonlarına karşı hayvanların duyarlılıkları, genellikle, değişiktir. Denemelerde beyaz veya özellikle, albinöz hayvanların kullanılmaları, sonuçları değerlendirme bakımından yararlar sağlayabilir. Deneme hayvanları her bakımdan sağlam ve derilerinde her hangi bir lezyon bulunmamalıdır.
04.01. Kutan Mikozesler
1-Klinik materyal inokulasyonu : Laboratuara teşhis amacı için gönderilen infekte (veya şüpheli) kıl, tüy, deri kazıntısı, vs. materyal çok az miktar SDA ile karıştırılır. Uygun deneme hayvanının karın veya yan tarafındaki bu amaç için hazırlanmış (5x5cm. alanındaki yerin kılları kesilir, derisi traş edilir ve ılık su ile iyice temizlenir, silinir ve kurutulur. Bu işlemler sırasında deriye zarar verilmemeye çalışılır ve deri kanatılmaz veya yaralanmaz. Eğer hayvan büyükse, daha geniş saha inokulasyon için hazırlanabilir) deriye cam çubukla bastırmak suretiyle sürülür. Bir çok hastalık etkenleri bu yolla deneme hayvanlarını infekte edebilir ve lezyonlar oluşturabilir.
2- Kültür inokulasyonu: Uygun olarak seçilen deneme hayvanının karın ve yan tarafından derisine, yukarıda bildirilen tarzda hazırladıktan sonra, kanatılmamak kaydıyla, zımpara kağıdı ile skarifikasyon yapılır. Fizyolojik su ile yoğun suspansiyonu yapılmış kültür veya bala karıştırılmış kültürler, cam bir çubukla bastırarak deriye sürülür. Hayvanların ekserisinin derisinde, inokulasyondan 3-5 gün sonra kızarıklıklar ve lezyonlar görülmeye başlar. Bir hafta sonra, infeksiyon etkeninin karakterine göre, bölgede ödem oluşur ve eksudat sızıntısına rastlanır. Bu eksudat, zamanla, sarı-beyaz bir kabuk oluşturarak kurur. Bazen, deride meydana gelen bu reaksiyon, daha şiddetli olabilir ve nekrozlar oluşturabilir.
Gelişmiş lezyonlardan alınan materyallerden, mikroskopik muayeneler, ekimler ve gerektiğinde histopatolojik yoklamalar yapılabilir. Deneme için genç kültürler tercih edilmeli (3-4 haftalık) ve eski kültürler de tazelendikten sonra kullanılmalıdırlar. Genellikle, aerial hifaları olmayan kolonilerden alınan inokulumlar başarısız sonuç vermektedirler.
Lezyonların oluşumu (erken veya geç) ve lezyonların karakteri inokule edilen mantarın türüne bağlıdır. Yeni izole edilmiş ve fazla spor oluşturan suşlar, kısa süre içinde lezyon meydana getirebilirler. Lezyonların oluşumu yönünden hayvanlar arasında bazı farklar olabilir. Bu nedenle böyle durumları hesaba katarak en azından 2 deneme hayvanı kullanmak yerinde olur.
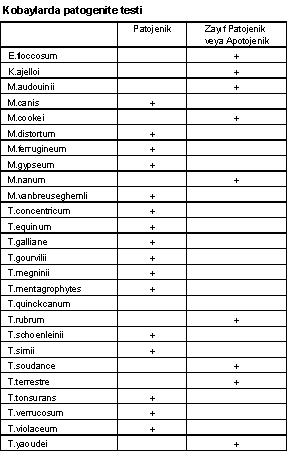
Aşağıdaki çizelgede bazı dermatofitlerin, kobaylarda patojenite durumları gösterilmiştir.
04.02. Subkutan ve Sistemik Mikozesler
Bu mantarların teşhisi için kullanılan deneme hayvanlarının seçimi (hayvanın türü, cinsi, yaşı) ve inokulasyon yolları bazı değişikliklerle birlikte Dermatofitlere ait kısımda bildirildiği gibidir. Mantarların türüne göre kullanılacak deneme hayvanı aşağıda gösterilmiştir.
Sporotrichum schenkii : Bu etkenin maya veya miselyal formundan hazırlanan suspansiyondan 0.3ml. farelerin testisleri içine şırınga edilir. Testislerde oluşan lezyonlardan hazırlanan preparatlar Gramla boyanarak mikroskop altında incelenir. Mikroskopta tomurcuklu veya tomurcuksuz hücreler aranır.
Blastomyces dermatitidis : Bu mantarın sporlarından veya maya benzeri kolonilerinden hazırlanan suspansiyondan %5 gastrik mucin ile aynı miktar karıştırıldıktan sonra, farelere i.p., 1 ml. verilmesi halinde infeksiyon meydana gelmektedir. Eğer ölüm olmazsa, hayvanlar iki hafta sonra öldürülür, oluşan veya görülen lezyonlardan preparatlar hazırlanarak lakto fenol pamuk mavisi ile boyanırlar ve mikroskop altında muayene edilirler.
Candida albicans : Bu mantarın 24-48 saatlik kültüründen hazırlanan %1 lik suspansiyondan (fiz su ile) tavşanların kulak venası içine 1 ml. şırınga edilir. Hayvanlar genellikle, 3-5 gün içinde ölürler. Böbreklerde oluşan küçük apse odaklarından elde edilen materyallerden preparatlar hazırlanır ve bunlar Gram yöntemi ile boyanırlar.
Gastrik mucin ile eşit miktarda karıştırılmış C. albicans, farelere karın içi olarak 1 ml. miktarında şırınga edilebilir.
Coccidioides immitis: Bu mantara ait kolonilerden suspansiyon hazırlanırken çok dikkat edilir. Fizyolojik su ile kobayların testis içi 0.5 ml. şırınga edilir. İnokulasyondan 7-10 gün sonra kobaylarda orşitis meydana gelir. Bu anda, hayvan öldürülür ve testislerde oluşan apse odaklarından preparatlar yapılır ve sporangiumlar yönünden incelenir. Mantarın artrosporlarından veya miselyumlarından hazırlanan suspansiyondan eşit oranda % 5 gastrik mucin ile karıştırıldıktan sonra 1 ml. miktarının karın içi kobaylara şırıngası lezyonların oluşmasına neden olabilir.
Cryptococcus neoformans : Bu mantarın 4-5 günlük kültüründen hazırlanan suspansiyon farelere beyin içine 0.03 ml. miktarında şırınga edilir. İnokulasyondan 10-12 gün sonra, hayvanın başı şişer ve fare ölür. Eğer ölümler meydana gelmezse hayvanlar ikinci hafta içinde öldürülür. Beyinde oluşan jelatinöz materyalden, India boyası ile preparat hazırlanır ve mikroskopta muayene edilir. Mikroskop altında kapsüllü yuvarlak hücreler aranır. Koloniden hazırlanan suspansiyonlardan 1 ml. karın içi olarak da verilebilir.
Histoplasma capsulatum : Bu etkenin BHI agar da üretilmiş maya benzeri formundan hazırlanan suspansiyon 8-10oC'de 2-3 saat tutulduktan sonra, farelerin kuyruk venasına 0.2 ml. miktarında şırınga edilir. Eğer hayvanlar bir hafta içinde ölmezlerse, farelerden biri veya ikisi öldürülür. Farelerin kanından, karaciğer ve dalağın kesit yüzlerinden preparatlar hazırlanarak Giemsa veya Wright boyama yöntemi ile boyanırlar.
Miselyal formunu, maya formuna döndürmek için, miselyal fragmentlerden veya sporlardan yoğun bir suspansiyon hazırlanarak farelere karın içi 1 ml. şırınga edilir. Ölen veya iki hafta sonra öldürülen farelerin dalak ve karaciğerinden preparatlar hazırlanır ve Giemsa ile boyanarak mikroskop altında incelenir. Mikroskopta küçük, oval ve tomurcuklu hücreler aranır. Organlardan, tüpteki BHI agara ekimler yapıldıktan sonra 37°C'de inkube edilirse maya benzeri formlar elde edilir.
Nocardia asteroides : Mantar suspansiyonu eşit miktarda gastrik mucin ile karıştırıldıktan sonra kobaylara karın içi 1 ml. şırınga edilir. İki hafta içinde ölen hayvanların dalak ve karaciğerlerindeki lezyonlardan preparatlar hazırlanır ve Kinyoun boyama yöntemi ile boyanarak mikroskop altında incelenirler.
05. Bazı Besi Yerleri
Mantarları üretmede kullanılan besi yerleri genellikle az sayıdadır. Bunlar da izolasyon ve özel besi yerleri olmak üzere 2 kısma ayrılabilirler. Ancak, bu ortamlar birbirinin yerlerine kullanılabilirler. Mantarları izole ve identifiye etmede yararlanılan başlıca besi yerleri şunlardır: Aşağıda belirtilen izolasyon ve identifikasyon besi yerleri, ticari firmalardan da, aynı amaçlar için temin edilebilir ve kullanılabilirler.
05.01. Sabouraud Dekstroz Agar
Patojenik mantarların ve dermatofitlerin izolasyonunda ve üretilmesinde en çok kullanılan bir ortamdır. Aşağıdaki tarzda hazırlanır:
Pepton 10.0 g.
Et ekstraktı 3.0 g.
NaCl 5.0 g.
Agar 17.0 g.
Distile su 1000.0 ml.
Yukarıdaki maddeler distile suya konur, alttan ısıtılarak ve karıştırılarak eritilir. Otoklavda 120°C de 20 dakika sterilize edildikten sonra içine, katılır
Dekstroz 40.0 g. (filtrasyonla sterilize edilir)
Maya özeti 3.0 g
Tiamin 0.05 g.
Kloramfenikol 0.04 g.
Aktidion (cyclohexamide) 0.5 g.
ve iyice karıştırılır. Ancak, kloramfenikol ve aktidionun özel olarak hazırlanması gereklidir. Bu amaçla, kloramfenikol 10 ml. % 70'lik alkolde ve aktidione de 10 ml. asetonda eritildikten sonra ilave edilir ve iyice karıştırılır. Eğer kloramfenikol bulunmazsa bunun yerine penisilin 20 U.I /ml. ve streptomisin 40 mcg. /ml. kullanılabilir. Besi yeri petri kutusunda veya tüp içine hazırlanır.
Bileşiminde bulunan aktidion (cyclohexamide) C. neoformans, Allescheria boydii, A. fumigatus, Candida krusei, C. tropicalis, C. parapsilosis, N. asteroides gibi mantarların üremelerini inhibe edebilir. Bu nedenle, bu etkenlerin izolasyonunda besi yerlerine antifungal madde katılmamalıdır. Dermatofitlere etkisi olmadığından, bunları izole etmede bu besi yerlerinden yararlanılır.
Aynı besi yeri aktidionsuz ve antibiyotiksiz olarak da saf kültürlerin devam ettirilmesinde kullanılır.
05.02. Sabouraud Glukoz Buyyon
Candida türlerinin ayrımında kullanılır. Aşağıdaki tarzda hazırlanır.
Glukoz 20.0 g.
Pepton 10.0 g.
Distile su I000.0 ml.
pH 5 .7
Maddeler distile suda ısıtılarak eritilir ve tüplere 10 ml. miktarında taksim edildikten sonra otoklavda sterilize edilir.
05.03. Littman Oxgall Agar
Bu besi yeri de patojenik bazı mantarların ve dermatofitlerin izolasyonunda kullanılır. Ancak, H. capsulatum, Nocardia ve Actinomycetesler için uygun değildir. Aşağıdaki tarzda hazırlanır:
Pepton 10.0 g.
Glukoz 10.0. g (filtrasyonla sterilize edilir)
Oxgall (Bacto) 15.0 g.
Agar 20.0 g.
Crystal violet 0.01 g.
Distile su 1000.0 ml.
Yukarıdaki maddeler 1 litre suya konur, karıştırılır ve ısıtılarak eritilir. Otoklavda 120 ° C'de 20 dakika sterilize edildikten ve 45-50 °C'de ılıklaştırıldıktan sonra streptomisin 30 mcg. /ml. ve sterilize edilmiş glukoz katılır ve iyice karıştırılır. Petri kutusu veya tüplere taksim edilir.
05.04. Beyin Kalp İnfusyon Agarı
Bu ortam, A. israelii ve A. bovis ’in izolasyon, üretimi ve aynı zamanda H. capsulatum ile B. dermatitidis’in oda ısısında izolasyonu için de kullanılır.
Aşağıdaki tarzda hazırlanır:
Beyin-kalp infüsyonu 37.0 g.
Kloramfenikol 0.05 g.
Cyclohexamide 0.05 g.
Agar 20.0 g.
Distile su 1000.0 ml.
Besi yerinin bileşimine giren aktidion ve kloramfenikol, Sabouraud dekstroz agarda bildirilen tarzda hazırlandıktan sonra, katılır. Besi yeri petri kutularına veya tüplere taksim edilerek kullanılır. Bu besi yerine % 10 kan katılarak üretme özelliği artırılabilir.
05.05. Mısır Unlu Agar
Bu ortam C. albicans ’ta klamidospor oluşturmak, Streptomycetesleri, perithecia veya pycnidia oluşturan mantarları üretmede kullanılır. Aşağıdaki tarzda hazırlanır:
Mısır unu 40 .0 g.
Agar 15.0 g
Distile su 1000.0 ml
Mısır unu 500 ml. distile suya konarak karıştırılır, kaynatılır, eritilir ve süzülür. Sonra içine 500 ml. suda ayrıca eritilmiş olan agar katılarak iyice karıştırılır. Tekrar süzülür. Otoklavda 120oC'de 20 dakika sterilize edilir, tüplere taksim edilir. Besi yerine %2 glukoz ve % 2 pepton katılabilir.
Bu ortama, % 1 Tween-80'in katılması klamidospor oluşumunu ve % 1 glukoz ilavesi de T.mentogrophytes ile T.rubrum 'un ayırımında işe yarar.
05.06. Malt Ekstrakt Agar
Bir çok mantarları izole etmede ve üretmede kullanılan bir ortamdır.
Aşağıdaki tarzda hazırlanır :
Malt ekstrakt 20.0 g.
Pepton 1.0 g.
Glukoz 20.0 g. (filtrasyonla sterilize edilir)
Agar 20.0 g.
Distile su 1000.0 ml.
Maddeler distile suya konur, karıştırılır ve ısıtılarak eritilir. Otoklavda 1200C'de 20 dakika sterilize edilir, sonra glukoz solusyonu katılır ve iyice karıştırılır. Tüplere taksim edilir.
05.07. Yulaf Unlu Agar
Streptomycetesleri, üretmede iyi bir ortamdır. Aşağıdaki tarzda hazırlanır:
Yulaf unu 30 .0 g.
Agar 15 .0 g.
Distile su 1000 .0 ml
Yulaf unu 500 ml. distile suya konur kaynatılarak eritilir ve süzülür. Su ilâvesiyle 1 litreye tamamlanır. Otoklavda 120° C'de bir saat sterilize edilir. Sonra agar ilave edilir ve 120° C'de tekrar otoklavda 20 dakika sterilize edilir. Tüplere taksim edilir.
05.08. Patates Dekstroz Agar
Bu ortam M. audouinii ile M. canis 'i ve T. rubrum ile T. mentagrophytes 'i ayırmada kullanılır.
Aşağıdaki tarzda hazırlanır :
Patates 200 gr. (haşlanmış soyulmuş küçük parçalar halinde)
Dekstroz 20 .0 g. (filtrasyonla sterilize edilir)
Agar 15 .0 g.
Distile su 1000.0 ml.
pH 6.6
Maddeler distile su da kaynatılarak eritilir, tüplere taksim edilir ve otoklavda 10 dakika sterilize edilir. (Patates ekstresi: yıkanmış, haşlanmış ve soyulmuş patates, iyice ezilir. Bundan 100 g. alınır ve 300 ml. suya karıştırılır. Buz dolabında bir gece bırakılır, süzülür ve otoklavda sterilize edilir).
05.09. Pirinçli Besi Yeri
Dermatofıtler için kullanılan bir ortamdır. M. audouinii ile M. canis 'i ayırmada kullanılır. Aşağıdaki tarzda hazırlanır :
Pirinç 16.0 g.
Distile su 50.0 ml.
Bir erlen mayere konan pirinç ve su, açık otoklavda kaynatılır ve tüplere taksim edilir. Otoklavda 12O° C'de 20 dakika sterilize edilir.
05.10. Czapek Agar
Penicillium, Aspergillus, Nocardia, v.s. mantarlar üzerinde araştırma yapmak için kullanılır. Aşağıdaki tarzda hazırlanır :
Sakkaroz 30.0 g.(filtrasyonla sterilize edilir)
K2HPO4 1 .0 g.
MgS04. 7.H2O 0.5 g.
Fe S04 0.1 g.
NaNO3 2.0 g.
Agar 15.0 g.
Distile su 1000.0 ml.
Maddeler (sakkaroz hariç) distile suya konur, eritilir ve otoklavda sterilize edilir. Sonra içine steril sakkaroz solusyonu ilave edilir. Petri kutusu veya tüplere taksim edilir.
05.11. Dermatofit Test Medium ( DTM )
Dermatofitlerin ayırımı için kullanılan indikatörlü bir ortamdır. Ekseri dermatofitler bu besi yerinde kırmızı renk oluştururlar. Saprofitler; bakteri ve mayalar renk meydana getirmezler.
Aşağıdaki tarzda hazırlanır :
Phytone 10 .0 g. (Baltimore)
Glukoz 10 .0 g.
Agar 20 .0 g.
Fenol red sol. 40.0 ml.
HCL, 0.8 M 6.0 ml.
Cyclohexamide 0.5 g. (Upjoehn Co.)
Gentamycin sulfat 100 mcg./ml. (Schering Corp)
Chlortetracycline HCI 100 mcg./m lederle lab)
Çok duyarlı olan besi yeri formülüne giren maddeler, belirlenen yerlerden sağlanması gereklidir. Aksi halde duyarlılığı azalır. Aşağıdaki tarzda hazırlanır.
1- Phyton, glukoz ve agar 1000 ml. distile suya katılır, ısıtılır ve karıştırılarak eritilir.
2- Karıştırılırken, 40 ml. fenol red solusyonu konur (fenol red 0.5 g. + 15 ml. 0,1 N NaOH içinde eritilir ve distile su ile 100 ml.ye tamamlanır.)
3- Besi yerinin pH'sı, 6 ml. 0,8 M HCI ile ayarlanır.
4- Cyclohexamide 0.5 g. + 2 ml. aseton içinde eritilerek ortama karıştırılır.
5- Gentamycin sulfat, 1 ml. sinde 100 mcg./ ml. olacak şekilde 2 ml. cam distile su içinde eritilir ve karıştırılır.
6- İyice karıştırıldıktan sonra 12 Ibr basınçta 10 dakika otoklave edilir ve 47° C'ye kadar ılıklaştırılır.
7- Klortetrasiklin 25 ml. steril camdan çekilmiş distile suda eritilir, katılır ve iyice karıştırılır.
8- Ağzı vidalı kapaklı şişelere konur ve yatık tarzda katılaştırılır. Vasatın pH'sı 5,5 + 0,1 kadardır.
Buzdolabında saklanır. Kontaminasyonlar yanlış sonuç verdirebilirler. İnokule edildikten sonra, kapağı gevşetilir ve 28-30° C. inkubasyona konur. Sonuç 14 güne kadar değerlendirilmelidir. İki haftadan sonraki değerlendirilmelerde yanlış pozitif reaksiyon görülebilir. Pozitif olgularda ortamın sarı rengi kırmızıya dönüşür.
05.12. Cysteinli Kanlı Agar
Mantarların maya formunu devam ettirmede kullanılan bir ortamdır.
Aşağıdaki tarzda hazırlanır:
Nütrient agar 100 ml.
Glukoz 1 g (filtrasyonla sterilize edilir)
Cysteine 0.1 g.
Nütrient agar eritildikten sonra içine steril 1 gr. dekstroz ile 0.1 gr. cysteine katılır, iyice karıştırılır ve homojen hale getirilir. Ortam 42-45° C'ye kadar ılıtıldıktan sonra içine 10 ml. steril defibrine koyun kanı ilave edilerek tekrar iyice karıştırılır ve petri kutularına (veya tüplere yatık olarak) dökülür.
05.13. Salvin YP Ortam
Bu besi yeri Histoplasma capsulatum için kullanılır.
Aşağıdaki tarzda hazırlanır:
Proteose-pepton 10.00 g.
Noepeptone 3.25 g.
Tryptone 3.25 g.
Glukoz 2.0 g.(filtrasyonla sterilize edilir)
NaCl 5.00 g.
Na2HPO4 2.50 g.
Agar 1.75 g.
Distile su 1000 ml.
pH 6.5-7.5
Yukarıdaki maddeler distile suya konarak ısıtılır,iyice eritilir ve pH'sı ayarlanır. Otoklavda 121 oC’de 15 dakika sterilize edilir. Sonra içine steril glukoz solüsyon katılır ve iyice karıştırılır. Tüplere 10 ml. miktarında dağıtılır. Buz dolabında muhafaza edilir.
05.14. Sabhi Agar Besi Yeri
Bu ortam doku sıvılardan, Blastomyces dermatitidis ve H. capsulatum 'u izole etmede kullanılır. Besi yerine: %10 steril koyun kanının (veya insan kanı) ilavesi izolasyon şansını artırır. Hazır besi yeri, oda ısısında (25°C) 2 ay kadar muhafaza edilebilir. Bu besi yeri aynı zamanda miselyal formları maya formuna döndürmede de (37°C'de.) kullanılır. İçine, genellikle, kloromisetin katılır.
Aşağıdaki tarzda hazırlanır.
Dana beyni infusyonu 100 g.
Sığır kalbi infusyonu 125 g.
Proteose pepton 5 g.
Neopeptone 5 g.
Glukoz 21 g.
NaCl 2.5 g.
Na2HPO4 15 g.
Hazır ortamdan 59 g. alınarak bir litre distile suya konur ve ısıtılarak eritilir. Otoklavda sterilize edildikten sonra 50°C'ye kadar ılıklaştırılır ve içine 1 ml. steril 100 mg./ml. kloromisetin solusyonu konur ve karıştırılır. Tüplere veya petri kutularına dökülür.
05.15. Casitone Nişasta Agar
Actinomyces türlerinde nişasta hidrolizasyonu testi için kullanılır.
Aşağıdaki tarzda hazırlanır:
Kalp infusyon buyyonu 25.0 g.
Casitone 4.0 g.
Maya ekstraktı 5.0 g.
Nişasta (eriyebilir) 5.0 g.
Agar 15.0 g.
Distile su 1000.0 ml.
pH 7.0
Maddeler distile suda ısıtılarak eritildikten sonra pH 7.0'ye ayarlanır ve tüplere 8 ml. miktarında taksim edilir
05.16.
Thioglucolate Besi Yeri
Actinomyces türlerinin izolasyonunda kullanılır.
Aşağıdaki tarzda hazırlanır:
Tripticase 20.0 g.
NaCl 5.0 g.
K2P04 2.0 g.
Sodyum Thioglucolate 1.0 g.
Metilen mavisi 0.5. ml
Distile su 1000.0 ml
Maddeler, distile suda eritilir ve tüplere 8 ml. taksim edildikten sonra otoklavda sterilize edilir.
05.17. Nitrat Redüksiyon Ortamı
Actinomyceteslerin nitrat redüksiyon durumunu ölçmede kullanılır. Aşağıdaki tarzda hazırlanır:
Kalp infusyon buyyonu 25.0 g.
Maya ekstraktı 5.0 g.
Casitone 4.0 g.
KNO3 1.0 g.
Distile su 1000.0 ml
pH 7.6
Maddeler distile suda ısıtılarak iyice eritildikten sonra tüplere 5 ml. miktarında taksim edilir ve otoklavda sterilize edilir. Testin uygulanışı aynen bakterilerdeki gibidir.
05.18. Kanlı Agar
Laboratuarlarda genel amaçla hazırlanan kanlı agara tiamin 10 mg. / litre ilavesiyle dermatofitlerin (T. mentagrophytes, T. rubrum, T. schoenleinii, T. verrucosum ve T. violaceum) makrokonidia formasyonunu artırır.
06. Diğer Test Ortamları ve Yöntemler
Mantarların kesin teşhisi oldukça güçtür ve bu konuda tecrübeli elamanlara gereksinim vardır. Laboratuara gelen materyalin muayenesi, ekimler sonu elde edilen mantar kolonilerinin makro-ve mikro morfolojileri, hayvan inokulasyonları ve serolojik-alerjik testler çoğu zaman güvenilir bir teşhise götürmeyebilir. Ayrıca, dermatofit mantarların koloni morfolojileri genellikle birbirlerine de çok benzerler. Bu nedenle yukarıda bildirilen muayenelerin dışında ve yanı sıra, bazı ayırıcı testlerin yapılması ve bunun sonuçlarının, diğer muayenelerinkilerle birleştirilerek teşhis konması daha isabetli olur. Bu amaçla aşağıdaki önemli bazı ortamlardan yararlanılır.
06.01. Kazein Agar
Ortam genellikle Nocardia ile Streptomycesleri ayırmada kullanılır. Streptomycesler kazeini hidrolize ederler.
Aşağıdaki tarzda hazırlanır:
Casein (%10 asit hidrolize) 25.0 ml.(vitaminsiz)
Glukoz 40.0 (filtrasyonla sterilize edilir.)
MgSO4 0.1 g.
KH2PO4 1.8 g.
Agar 20.0 g.
Distile su 1000.0 ml
Maddeler distile suya konur, alttan ısıtılır ve karıştırılarak eritilir. Erlen mayerlere (100 ml. lik) taksim edilir ve 120°C'de 15 dakika otoklavda sterilize edilir.
Bu ortam, aynı zamanda sütle de hazırlanabilir. Bu taktidir de açık otoklavda 1000°C de 3 gün arka arkaya 45 - 50 dakika sterilize edilmiş yağsız sütten %10'luk bir suspansiyon hazırlanır. Sonra, % 2 erimiş agarla karıştırılarak petri kutularına dökülür.
Bu besi yerinde Streptomyces türleri çok geniş bir hidrolizasyon alanı meydana getirirler.
06.02. Peptonlu Su
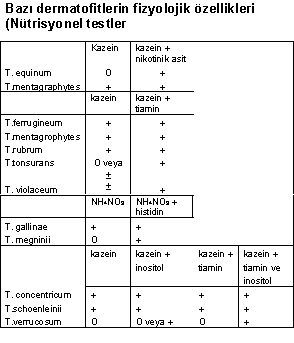
Bazı dermatofitlerin (T. mentagrophytesve T. rubrum) identifikasyonunda %10 peptonlu su kullanılır. T. mentagrophytes yüzeyde ürer ve kolonileri hafif kahve renklidir. T. rubrum ise, beyaz, pamuk gibi ve hemisfer koloniler oluşturur.
06.03. Amonyum Nitrat Agarı
Bu ortam, Trikofıtonların üreme karakterlerini saptamada işe yarar. Yukarıda bildirilen kazein agar besi yerindeki casein yerine,1.5 gram NH4N03 koymakla elde edilen bu ortam aynı tarzda hazırlanır.
NH4NO3 1.5 g.
Glukoz 40.0 g. (filtrasyonla sterilize edilir)
Mg504 0.1 g.
KH2PO4 1.8 g.
Agar 20.0 g.
Distile su 1000.0 ml
T. megninii ile M. gallinae 'yi ayırmada amonyum nitrat agar içine histidin (30 mcg./ml.) katılır. T. megninii histidinli ortamda ürer, M. gallinae ise her iki ortamda (histidinli ve histidinsiz) üreyebilir.
06.04. Üre Agar
Bu ortamdan ürease testi için yararlanılır. T. mentagrophytes üreyi çabuk hidrolize ederek koyu kırmızı renk meydana getirir. T. rubrum ise daha yavaş reaksiyon oluşturur. Aşağıdaki tarzda hazırlanır :
Pepton 1.0 g.
NaCl 5.0 g.
KH2PO4 2.0 g.
Glukoz 5.0 g.
Agar 20.0 g.
Distile su 1000.0 g.
Maddeler distile suda ısıtılarak eritilir, içine 2 ml. fenol red solusyonu (% 50 alkolde % 0.2) katılır ve 115°C'de 15 dakika otoklave edilir, ılıklaştırılır (45 - 50oC) ve içine 100 ml. üre solusyonu (%20 ve filtrasyonla sterilize edilmiş) katılır ve iyice karıştırılır. Tüplere konur ve yatık tarzda katılaştırılır. Sonuçlar bir hafta sonra değerlendirilir. Koyu kırmızı renk pozitiftir.
06.05. Jelatinli Ortam
Bu ortam daha ziyade, N. asteroides ile N. brasiliensis 'i birbirinden ayırmada kullanılır. N. asteroides jelatinli ortamda üremez. Buna karşın N. brasiliensis iyi gelişir. Aşağıdaki tarzda hazırlanır.
Jelatin 4.0 g.
Distile su 1000.0 ml.
Otoklavda sterilize (110°C'de 15 dakika) edildikten tüplere taksim edilir.
Jelatin erime testi yapmak için bir litre buyyona 120 gram jelatin koymak ve eritmek gereklidir. Test aynen bakterilerde olduğu gibi değerlendirilir. Ayrıca aşağıdaki besi yerinden de aynı test için yararlanılır.
Jelatin 100.0 g.
Kalp infusyon buyyon 25.0 g.
Casitone 4.0 g.
Glukoz 5.0 g.
Maya ekstraktı 5.0 g.
Distile su 1000.0 ml.
pH 7.0
Maddeler distile suda eritilir ve tüplere taksim edilir. Otoklavda sterilize edilir.
06.06. Tiamin, İnositol, Nikotinik Asit ve Histidine Gereksinim Testi
Mantarların adı geçen maddelere olan ihtiyaçları değişiktir. Bu amaç için vitaminsiz kazein hidrolizat besi yeri kullanılır. Aşağıdaki tarzda hazırlanırlar :
A- Esas ortam kazeinli agar.
B- Tiamin solusyonu
Tiamin HCI 1.0 mg.
Distile su 100.0 ml.
C- İnositol solusyonu
İ-İnositol 250 .0 mg.
Distile su 100.0 ml.
D- Histidin solusyonu
L- Histidin 150.0 mg.
Distile su 100.0 ml.
E- Nikotinik asit
Nikotinik asit 10.0 mg.
Distile su 100.0 ml
Bu vitamin solüsyonları otoklavda 120°C'de 10 dakika sterilize edilir ve buzdolabında (15°C) saklanır. Kullanılacağı zaman kazeinli 100 ml. besi yerine 2 ml. stok vitamin solüsyonundan katılır.
T. equinium, nikotinik asitli ortamda ürer.
T. verrucosum, vitaminsiz ortamda üremez.
İnositol ve tiaminli ortamda ürer.
06.07. Tyrosine Testi
N. asterodies ile N. brasiliensis 'in üreme durumlarını kontrol etmek için tirosinli ortam kullanılır. N. asteroides bu ortamda iyi, N. brasiliensis ise çok zayıf bir üreme gösterir. Aşağıdaki tarzda hazırlanır:
Pepton 5.0 g.
Et ekstraktı 3.0 g.
Agar 15.0 g.
Tyrosine 5.0 g.
Distile su 1000.0 ml
Ortamın pH'sı 7.0 'ye ayarlanır. Hazırlanan besi yeri petri veya tüplere taksim edilerek kullanılır.
06.08. Kıl İnvazyon (Perforasyon) Testi (Keratinolizis)
Bu test dermatofitlerin kıl üzerinde yaptığı erimeleri ortaya koymak için uygulanır. Mantarların keratinolitik aktivitesini ölçmede çeşitli steril hayvan ve insan kılları kullanılabilir. Kıllar iyice yıkanıp, kurutulduktan sonra 0.5-1 cm. uzunluğunda kesilerek petri kutusuna konur ve otoklavda sterilize edilir. Bir tüp veya petrideki besi yeri (Czapak) üzerinde 8-10 tane kıl konur ve denenmek istenen mantar inokule edilir. On gün sonra kıllardan bazıları çıkarılır, lâm üzerine konur, lakto fenol damlatılır ve lamel kapatılarak mikroskopta incelenir. Kıllarda dıştan içe doğru olan erimeler pozitif olarak değerlendirilir.
Dermatofitler tarafından kılın invazyonu yandaki şekilde gösterilmektedir. | 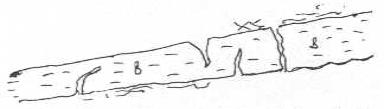
|
Aşağıdaki çizelgede mantarların, hayvan türlerindeki invazyon testi gösterilmektedir.

06.09. Germ Tüp Testi
Bu testte hücrelerden germ tüpü oluşumu aranır. Aşağıdaki tarzda yapılır:
1- Maya benzeri mikroorganizmalardan 0.5-1.0 ml steril serum ( sığır ve koyun ) içinde hafif bir suspansiyon yapılır.
2- Süspansiyon 37°C'de 3 saat inkube edilir.
3- Karışımdan bir damla lâma konur ve üzeri lâmelle kapatılır.
4- Mikroskop altında hücrelerden germ tüpünün meydana gelip gelmediği araştırılır.
C. albicans ' ta bu durum karakteristiktir.
06.10. Dimorfik Mantarların Maya Formuna Dönüştürülmesi
Miselyal formda üremiş (25°C'de) mantarlar, uygun ortama (BH agar) inokule edildikten sonra 37°C'de üretilirse, maya benzeri forma dönüşür. Ancak bazen birkaç pasaj yapmak gerekir.
07. Solüsyonlar
07.01. Potasyum Hidroksit ( %10 )
Klinik materyalleri direkt muayenede kullanılan bir solüsyondur. KOH'lı lâmın hafifçe ısıtılması materyalin çabuk berraklaşmasını ve dolayısıyla da kolay görülmesini sağlar. Potasyum hidroksit % 20 yoğunlukta, materyali 30-60 dakika berraklaştırır. Bazı mantarlarda (Candida gibi) yalancı formasyonlara neden olması sebebiyle kullanılmamalıdır. Solüsyon taze hazırlanmalıdır.
07.02. Parker Boyası + KOH
Dermatofitleri daha iyi görmede eşit miktarda hidroksit solüsyonuna (% 10), Parker mavisi (%10) katılabilir. Bir ay kadar muhafaza edilebilir.
07.03. Gliserinli Potasyum Hidroksit
Epidermal kazıntı ve kabukları berraklaştırmada kullanılan bir solüsyondur.
Aşağıdaki tarzda hazırlanır:
KOH 5.0 g.
Gliserin 25.0 g.
Distile su 100.0 ml.
Hazırlandıktan 60 dakika sonra kullanılabilir.
07.04. Lakto fenol Pamuk Mavisi (Aman's Solusyonu)
Klinik materyallerin ve kültürlerin mikroskopik muayenelerinde kullanılan bir solüsyondur. Aşağıdaki tarzda hazırlanır:
Fenol (kristal) 20.0 g.
Laktik asit 20.0 g.
Gliserin 40.0 g.
Pamuk mavisi (anilin mavisi) 0.05 g.
Distile su 20.0 ml.
Fenol distile suya katılır ve eritilir. Sonra diğer maddeler ilave edilerek iyice karıştırılır. Uzun süre saklanabilir.
07.05. Polivinil Alkol Solusyonu
Materyalleri ve özellikle, kültürleri muayenede kullanılır. Aşağıdaki tarzda hazırlanır:
Polivinil alkol 10.0 g.
Kloralhidrat 20.0 g.
Laktik asit 35.0 ml.
Karbolik asit (% 15) 25.0 ml.
Gliserin 10 .0 ml.
Distile su 50.0 ml.
Yukarıdaki maddeler distile su içinde birbirlerine karıştırılır. Karanlık şişede ve ağzı sıkıca kapalı olarak muhafaza edilir.
08. Boyalar
Dokularda bulunan mantar elementlerini ortaya koymada bir çok yöntemler vardır. Ancak, doku kesitlerinin hazırlanması ve boyanarak muayene edilmeleri genellikle zaman alıcı bir durum gösterir. Buna rağmen, yine de, mikozeslerin kesin teşhisi için boyama yöntemlerinden fazlaca yararlanılır.
Biyopsi ve klinik materyallerinin histopatolojik muayeneleri için alınan örnekler hemen bufferli % 10 formalin solusyonuna (4g. NaH2 PO4 +1000 ml. %10 formalin +%6.5 g. Na2 PO4) veya Zenker + formol solusyonuna konarak fikse edilirler. Fikse edici solüsyonun miktarı, genellikle alınan materyalin 20 katı kadar olmalıdır. Materyal 0.5 cm.den fazla büyüklükte ise, fiksatifin etkimesi için daha küçük parçalara ayrılabilirler. Materyaller fiksatif içinde 24-48 saat bırakıldıktan sonra çıkarılır, çeşme suyunda yıkanır ve tekrar %10'luk formalin solusyonuna konur. Kavanozun ağzı çok iyi kapatıldıktan sonra laboratuara gönderilir. Laboratuarlarda mantarları boyamada en çok kullanılan boyama yöntemleri aşağıdaki gibidir.
08.01. Gram Boyama Yöntemi (Hucker Modifikasyonu)
Klinik materyallerde, kraşede diğer sıvılarda ve dokularda mantar elementlerini ortaya koymada kullanılan bir tekniktir. Ancak bir çok modifikasyonları bulunmaktadır (Hucker, Mac Callum, Brown-Hopps, v.s.). Bunlardan birinin seçimi araştırıcının tercihine ve tecrübesine kalmıştır. Mantar elementleri Gram pozitiftir.
Solüsyonlar
1-Kristal violet sol
A- Kristal violet 4.0 g. (%85 boya içerikli)
Etil alkol (% 95) 20.0 ml.
B-Amonyum oksalat 0.8 g.
Distile su 80.0 ml.
Kristal violet alkolde iyice eritildikten sonra distile su ile 1/10 sulandırılır. Bir kısım kristal violet sol. (1/10) ve 4. kısım sol. B ile (amonyum oksalat sol.) ile karıştırılır.
2- Lugol solusyonu
İyot 1.0 g.
KI 2 .0 g.
Distile su 300 .0 ml.
Bir havan içine konan materyaller, azar azar ilave edilen distile su içinde eritilirler. Tam erimesi için bir gece bekletilir.
3-Safranin solusyonu
Safranın(%2.5 sol. %95 alkolde) 10 ml.
Distile su 100 ml.
Boya solusyonu distile suya iyice karıştırılır. Boyama yöntemi
1- Preparat lâm üzerine hazırlanır, kurutulur ve alevde tespit edilir.
2- Kristal violet ile bir dakika boyanır.
3- Hafif akan su ile yıkanır.
4- Lugol solusyonu ile bir dakika muamele edilir.
5- Hafif akan su ile yıkanır.
6- Alkol ( %95 ) veya alkol + aseton karışımı (eşit miktarda) ile dekolore edilir.
7- Hafif akan su ile yıkanır.
8- Safranın solusyonu ile 10 saniye boyanır.
9- Hafif akan su ile yıkanır.
10- Kurutulur (havada).
11- Mikroskopla muayene edilir (önce küçük büyütme, sonra immersiyonla).
08.02. Kinyoun’un Boyama Yöntemi
Bu yöntem daha ziyade Nocardiaları ayırmada kullanılır. N. asteroides ve N. brasiliensis hifaları kısmen asido-rezistans özellik gösterirler.
Solüsyonlar
1- Bazik fuksin 4.0 g.
Fenol 8.0 g
Alkol (% 95) 20.0 ml.
Distile su 100.0 ml.
2- HCL (konsantre) 3 g ml.
Etil alkol 97 ml.
3- Metilen mavisi 2.5 g
Alkol (% 95) 100.0 ml.
Solüsyonlar ayrı ayrı hazırlanırlar.
Boyama yöntemi
1- Preparat hazırlanır, kurutulur ve alevde tespit edilir.
2- Lâm üzerini kaplayacak tarzda karbol fuksin solusyonu konur ve oda ısısında 3 dakika boyanır.
3- Hafif akan su ile yıkanır.
4- Asit + alkol içinde 5-10 saniye dekolore edilir.
5- Hafif akan su ile yıkanır.
6- Metilen mavisi ile 30 saniye boyanır.
7- Hafif akan su ile yıkanır.
8- Kurutulur (havada).
9- Mikroskopta muayene (immersiyonla) edilir.
08.03. Ziehl Neelsen Boyama Yöntemi
Aynı Mycobacterileri boyamada olduğu gibi hazırlanır, kullanılır ve değerlendirilir.
08.04. Giemsa Boyama Yöntemi
Bu yöntemle H. capsulatum iyi bir şekilde görülür.
Solüsyonlar
1- Stok solusyonu
Giemsa tozu 600 .0 mg.
Metil alkol (asetonsuz) 50.0 ml.
Gliserin (nötral) 50.0 ml.
Giemsa tozu bir havana konur ve az bir gliserin içinde ezilerek eritilir. Bir silindire alınır ve üst 1/3 kısmı temiz bir şişeye konur. Geride kalan kısma gliserin konarak ezilir ve aynı şişeye aktarılır. Şişenin ağzı kapatılır ve 55oC'de 2 saat tutulur. Her yarım saatte bir hafifçe çalkalanır. Bu sürenin sonunda karışım soğutulur. Havanda kalan boya alkolle toplandıktan sonra tekrar aynı şişeye aktarılır. Kullanılmadan önce iki hafta bekletilir. Damlalıklı şişe içinde kullanılır.
2- Buffer solusyonu (pH 7.2)
Na2HPO4 (susuz) 6.77 g.
KH2PO4 2.59 g
Distile su 1000 .0 ml.
3- Boyama solusyonu
Stok boya solusyonu 2.0 ml.
Buffer sol. 6.0 ml.
Bunlar birbirine katılarak iyice karıştırılırlar.
Boyama yöntemi
1- Preparat hazırlanır, kurutulur ve metil alkolde (% 100) 3-5 dakika fikze edilir.
2- Boya solüsyonunda 15 dakika boyanır.
3- Hafif akan suda yıkanır.
4- Kurutulur (havada).
5- lmmersiyonla muayene edilir.
08.05. Periodik Asit Schiff ( PAS ) ile Boyama
Patojenik mantarları özellikle, C. neoformans, H. capsulatum, B. dermatitidis, C. albicans v.s.gibi mantarlar ile deri ve tırnak kazıntılarını muayenede kullanılır.
Doku seksiyonları da aynı yöntemle boyanarak muayene edilirler.
A- Deri kazıntıları için: Temiz bir lâmın üzeri Mayer albumini ile kaplandıktan sonra deri kazıntıları konur ve iyice bastırılır, alttan hafifçe ısıtılır ve kazıntıların lâma yapıştığına dikkat edilir.
1-Alkol (% 95) içine bir dakika daldırılır.
2- Periodik asit (%5) içine de beş dakika bırakılır.
3- Aşağıdaki solüsyona 2 dakika bırakılır.
Bazik fuksin 0.1 g.
Alkol (% 95) 5.0 ml.
Distile su 95.0 ml.
4- Preparat hafif akan suda yıkanır.
5- Aşağıdaki solüsyona 10 dakika süre ile daldırılır.
Zink(veya sodium)hidrosulfit. 1.0 g.
Tartarik asit 0.5 g.
Distile su 1000.0 ml.
6- Preparat hafif akan suda yıkanır.
7- Aşağıdaki boyalardan biri ile boyanır. Ya satire pikrik asit ile 2 dakika veya light green ile 5 saniye boyanır.
Light green 1.0 g.
Glacial acetic asit 0.25 ml.
Alkol (% 80) 100.0 ml.
8- Suda hafifçe yıkanır.
9- Alkol de ( %95 ) 10 saniye ve % 100 alkolde 1 dakika tutulur. Sonra ksilol içinde 2 defa (her biri birer dakikalık) yıkanır. Kurutulduktan sonra üzerine polivinil alkol-kloral hidratlı solüsyon konur ve lâmelle kapatılarak mikroskopta muayene edilir.
Mantar parlak kırmızı veya mavi-kırmızı renkte görülür.
B- Doku seksiyonları için: Dokular fikse edildikten, kurutulduktan ve parafin içine yatırıldıktan ve kesildikten sonra rutin yöntemle boyanır.
1- Kesit, ksilol içine konarak deparafinize edilir.
2- Alkolde ( % 100 ) yıkanır.
3- Distile suda yıkanır.
4- Periodik asit (% 1 ) içinde 10 dakika tutulur.
5- Su içinde 5-10 dakika tutulur.
6- Aşağıdaki solüsyonda 2 dakika tutulur.
Bazik fuksin 0.1 g.
Alkol ( %95 ) 5.0 ml.
Distile su 95.0 ml.
7- Suda 10 saniye yıkanır.
8- Zink hidrosulfit solüsyonunda 2-3 saat tutulur.
9- Suda 3-5 dakika yıkanır.
10- Light green solüsyonunda 2 dakika boyanır.
11- Suda kısa bir süre yıkanır.
12- Alkolde ( %95 ) 10 saniye ve %100 alkolde bir dakika tutulur. Sonra ksilol içinde 2 defa (her biri birer dakikalık) yıkanır.
Kuruduktan sonra üzerine polivinil alkol kloralhidrat solusyonu konarak lâmelle kapatılır. Mikroskop altında muayene edilir.
08.06. Gridley Boyama Yöntemi
Doku kesitlerinde mantar elementlerini (spor, hifa, v.s.) görmede ve incelemede kullanılır.
Bu muayenede uygun bir fiksatifle iyice tespit edilmiş 6 mikrometre kalınlığında parafin seksiyonları kullanılır.
Aşağıdaki tarzda hareket edilir.
1- Kesitler ksilol, absolut alkol ve % 95 alkolle deparafinize edilir.
2- Kromik asit (%4) içinde 1 saat bekletilir. (Okside).
3- Akan suda 5 dakika yıkanır.
4- Colemen feulgen reagentinde 15 dakika bekletilir.
5- Sulfuroz asitte 3 dakika yıkanır (her biri 2 dakika)
6- Akan suda 15 dakika yıkanır.
7- Preparat aldehit-fuksin solusyonuna 15-30 dakika süre ile konur.
8- Alkolle (%95) yıkanır. Fazla boya atılır.
9- Suda yıkanır.
10- Metanil yellow boyası ile 2-5 dakika boyanır.
11- Suda yıkanır.
12- Alkol ( %95 ) ve absolut alkolde dehidre edilir.
13- Ksilolde berraklaştırılır.
14- Permounta yatırılır.
Sonuç: Miselyum, koyu mavi konidiumlar koyu kırmızı ve purpul, zemin sarı, elastik doku ve musin ise mavi boyanır.
Bu boyama yönteminde kullanılan bazı solüsyonlar:
Kromik asit solusyonu (taze)
Kromik asit 4.0 gr.
Distile su 100.0 ml.
Coleman Feulgen reagenti
Bazik fuksin 1.0 gr.
Distile su 100.0 ml.
Bazik fuksin sıcak distile suda eritilir, soğutulur ve filtre edilir. Filtrata 2 g. sodyum metabisulfit ve 10 ml. normal HCI ilave edilir. Karışım 2. saat bekletildikten sonra 0.5 g. aktif karbon katılır ve bir dakika çalkalanır, sonra, kaba kağıttan süzülür. Filtrat renksiz olmalıdır. Buz dolabında saklanır.
Normal HCI solusyonu
HCI (1.19) 83.5 ml.
Distile su 916.5 ml.
Sodyum metabisulfit solusyonu
Sodyum metabisulfit 10.0 g.
Distile su 100.0 ml.
Sulfuroz solusyonu
Sodyum metabisulfit (% 10) 6.0 ml.
Normal HCI 5.0 ml.
Distile su 100.0 ml.
Aldehit-fuchsin solusyonu
Bazik fuchsin 1.0 g.
Alkol (%10) 200.0 ml.
Paraaldehid 2.0 ml.
HCI (yoğun) 2.0 ml.
Bu solüsyon oda ısısında saklanır. Kullanmadan önce filtre edilir.
Metanil yellow solusyonu
Metanil yellow 0.25 g.
Distile su 100.0 ml.
Glacial asetik asit 0.25 ml.
Mucicarmin boyası
Carmine 1.0 g.
Alüminyum klorid (susuz) 0.5 g.
Distile su 2.0 ml.
Materyal küçük bir tüpte karıştırılır. Alevde 2 dakika ısıtılır. Sıvı, siyah ve şurup gibi bir görünüm alır. Alkol (% 50) 100 ml. katılarak dilue edilir ve 24 saat bekletilir. Filtre edilir ve 1/4 oranında su ile sulandırılarak kullanılır.
08.07. Akridin Oranj Boyası
Bu boya, preparatlarda, doku kesitlerinde ve taze materyallerdeki mantar elementlerini ortaya koymada yararlı olur. Bu boya ile aşağıdaki tarzda boyama yapılır.
Kıl ve deri kazıntılarını muayene
1- %20 KOH solüsyonundan hazırlanır.
2- %0.1 akridin oranj solüsyonundan 1 ml. alınarak 9 ml. KOH ( %20 ) katılır.
3-Temiz bir lâm üzerine 2 damla acridin oranj solusyonu ve bunun üzerine de kıl,deri ve tırnak kazıntıları konulur. İyice karıştırılır.
4- Üzeri lâmelle kapatılır.
5- Preparat çok hafifçe ısıtılır.
6- Özel mikroskopta muayene edilir.
Doku kesitlerini muayene
1- Parafinli ince kesitler ksilol ve alkol solüsyonlarından geçirildikten sonra distile su ile yıkanır.
2- Weigert demir hematoxylen ile 5 dakika boyanır.
3- Akan suda 3-5 dakika yıkanır.
4.- Acridin oranj (% 0.1) ile 2 dakika boyanır.
5- Akan suda 30 saniye yıkanır.
6- Alkol (% 95) içinde bir dakika dehidre edilir.
7- Absolut alkolde 2-3 kez dehidre edilir.
8- Ksilolde berraklaştırılır.
9- Üzerine fluoresans vermeyen bir medium konarak lâmel kapatılır.
10- Özel mikroskopla muayene edilir.
09. Antifungal İlaçlar (Antifungal Kemoterapötikler)
Mantar infeksiyonlarında proflaksi ve sağaltım, bakteri hastalıklarından daha az başarılı olduğu gibi daha fazla da zaman alır. Bakterileri etkileyen ilaçların çoğu mantar infeksiyonlarında kullanılamazlar. Çünkü, bakteriler prokaryotik olup, yapıları ökaryotik olan mantarlardan farklıdır. Bakterilerin etrafında peptidoglikan, lipopolisakkarid, protein kompleksleri bulunmasına karşın, mantar hücre duvarlarında kitin, selüloz ve diğer polisakkarid bileşikleri vardır.
Mantarlar, insan ve hayvanlarda, iki karakterde hastalık oluştururlar. Bunlardan biri mantar toksinlerinin (mikotoksin) oluşturduğu mikotoksikozisler ve diğeri de mantarların bizzat kendilerinin meydana getirdiği infeksiyonlardır (mikozes). Antifungal ilaçlar, mikotoksikozislerde kullanılamazlar. Ancak, mikozes olgularında, mantar hücreleri üzerine olumsuz etkide bulunurlar. Mantarlar aynı zamanda ilaçları modifiye ve inaktive edecek mekanizmalara da sahiptirler.
Antifungal substansların bazıları, çeşitli mantarlardan fermentasyon suretiyle elde edilirler. Pratikte bulunan antimikotik ilaçların hemen hepsi de yüzeysel ve sistemik mantar infeksiyonlarında kullanılırlar. Mikotoksikozislerde ise yararlanılamazlar.
Yüzeysel mantar infeksiyonlarının teşhisi kolay, buna karşın tedavisi zor ve zaman alıcıdır. Bazen de tam bir sağaltım gerçekleştirilemez. Sistemik infeksiyonları teşhis ve tedavi oldukça güçtür. Bazen de imkansızdır.
Antimikotik ilaçların çoğu daha ziyade, Chitin senthase ve sterol sentezine etkilerler. Hücre duvarı yapısının kimyasal bileşimini bozarlar. Membranda delikler açar, permeabiliteyi bozar ve sterol sentezini inhibe ederler.
Mikozislerde kullanılan antifungal ilaçlardan başlıcaları aşağıda bildirilmiştir.
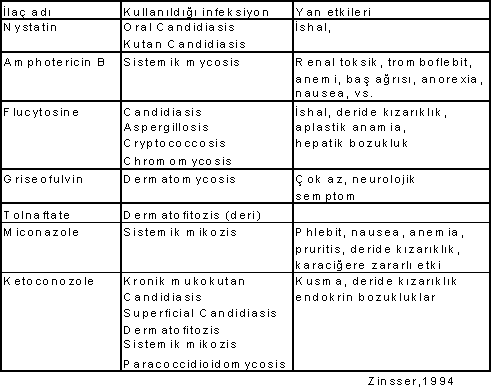
Amphotericin B: Bu ilaç Streptomyces nodosus 'tan elde edilir. Mantar hücre duvarındaki sterole bağlanarak hücre permeabilitesini bozar. Sistemik mikozeslerde kullanılır. Yan etkileri vardır.
5- Flucytosine : 5- Fluorocytosine, sentetik antimikotik bir preparat olup, sistemik mantar infeksiyonlarında kullanılır. İlaç, mantar hücre RNA'sı ile birleşerek fonksiyonlarını bozar. İlaca karşı dirençlilik oluşabilir. Yan etkileri vardır.
Fluconazole, Clotrimazole ve Tereonazole : Aynı amaçlarla kullanılan antimikotik preparatlardır.
Griseofulvin : Penicillium griseofulvinden elde edilen antifungal bir substanstır. Dermatofitlerden ileri gelen süperfisial mikozislerde kullanılır. İlaç nukleik asite etkileyerek hücre bölünmesine mani olur.
Dermatofitlerin ve sistemik mikozeslerin sağaltımında geniş spekturuma sahip olan imidozollu antifungal ilaçlar tercihen kullanılmaktadır. Bunlar sitoplasmik membrandaki sterollerin sentezini bozarak permeabiliteye olumsuz yönde etkilerler.
Ketoconazole : Kronik Candidiasis, dermatofitosiz ve sistemik mikozeslerde kullanılan bir ilaçtır. Yan etkileri vardır.
Miconazole : Bu ilaç Candidiasis ve sistemik mantar infeksiyonlarında kullanılır. Deride krem veya losyon tarzındaki preparatlardan yararlanır. Sistemik infeksiyonlarda parenteral kullanıldığında yan etkileri olabilir.
Nystatin (C46 H75 NO18 ) : Streptomyceslerden elde edilen polyene bir antibiyotiktir. İlaç, özellikle, Candidaların hücre duvarındaki sterollere bağlanarak permeabiliteyi bozar. Nystatin, Candida infeksiyonlarının kontrolünde yararlanılır.
Tolnaftate : Kutan mantar infeksiyonlarında yararlanılan bir ilaçtır.
Bazı antifungal kemoterapötiklerin kullanıldığı infeksiyonlar ve yan etkileri aşağıdaki tabloda gösterilmiştir.
[1] Kaynak : Temel Mikrobiyoloji